
下列关于物质或离子检验的叙述正确的是
A、 在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+
B、 气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气
C、 灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+
D、 将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2
科目:高中化学 来源: 题型:
现有可逆反应m A(g)+ n B(g)  x C(g);ΔH = a kJ/mol。该反应在不同温度和压强条件下,反应物A的转化率的变化情况如图所示。下列判断正确的是
x C(g);ΔH = a kJ/mol。该反应在不同温度和压强条件下,反应物A的转化率的变化情况如图所示。下列判断正确的是
 A.a < 0,m+n < x
A.a < 0,m+n < x
B.a < 0,m+n > x
C.a > 0,m+n < x
D.a > 0,m+n > x
查看答案和解析>>
科目:高中化学 来源: 题型:
“中和热的测定”实验步骤为:
① 准备反应装置(如右图)。
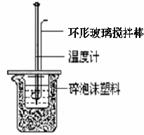
② 用一个量筒量取40 mL 0.50 mol/L盐酸,倒入小烧杯中,并用温度计测量盐酸的温度,记录。然后把温度计上的酸用水冲洗干净。
③ 用另一个量筒量取40 mL 0.55 mol/LNaOH溶液,并用温度计测量NaOH溶液的温度,记录。
④ 把温度计和_____________________放入小烧杯的盐酸中,并把量筒中的NaOH溶液一次倒入小烧杯(注意不要洒到外面)。用环形玻璃搅拌棒轻轻搅动溶液,并准确读取混合溶液的最高温度。
⑤_____________________________________________________________________。
⑥ 根据实验数据计算中和热。
请回答下列问题
(1)补全第④步中所缺仪器__________________。
(2)补全第⑤步操作步骤__________________。
(3)第②步如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的ΔH__________________。(填“偏大”“偏小”或“无影响”)。
(4)近似认为0.50 mol/L盐酸0.55 mol/LNaOH溶液的密度都是1g/mL,中和后生成的溶液的比热容c=4.18J/(g·℃),起始平均温度为t1℃,反应后最高温度为t2℃,则中和热(不用化简):
ΔH=__________________。
(5)0.50L 1.00 mol/L H2SO4溶液与1.00 L 1.00 mol/L NaOH溶液完全反应,放出57.16kJ的热量,写出该中和反应的热化学方程式
__________________________________________________________________。
(6)_______(填“能”或“不能”)用稀Ba(OH)2和稀硫酸代替盐酸和NaOH溶液,理由是____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中微粒的物质的量浓度关系正确的是( )
A.氯水中:c(Cl2)=2c(ClO-)+2c(Cl-)+2c(HClO)
B.Na2CO3溶液:c(OH-)+c(H+)=c(HCO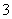 )+2c(H2CO3)
)+2c(H2CO3)
C.等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO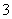 )+c(H2CO3)
)+c(H2CO3)
D.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性:
c(Na+)>c(SO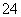 )>c(NH
)>c(NH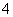 )>c(OH-)=c(H+)
)>c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,0.1 mol Na2CO3与盐酸混合得到一组体积为1 L的溶液,溶液中部分微粒与pH的关系如图所示,下列有关溶液中离子浓度关系叙述正确的是( )
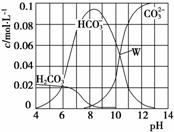
A.W点所示的溶液中:c(CO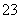 )=c(HCO
)=c(HCO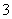 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B.pH=4的溶液中:c(H2CO3)+c(HCO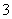 )+c(CO
)+c(CO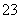 )=0.1 mol·L-1
)=0.1 mol·L-1
C.pH=8的溶液中:c(Na+)>c(HCO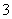 )>c(CO
)>c(CO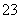 )>c(H2CO3)
)>c(H2CO3)
D.pH=11的溶液中:c(Na+)+c(H+)=c(OH-)+c(Cl-)+c(CO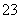 )+c(HCO
)+c(HCO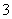 )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
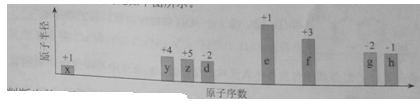
根据判断出的元素回答问题:
(1)f在元素周期表的位置是__________。
(2)比较d、e常见离子的半径的小(用化学式表示,下同)_______>__________;比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______>__________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式__________。
(4)已知1mole的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:___________________。
(5)上述元素可组成盐R:zx4f(gd4)2,向盛有10mL1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:
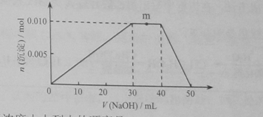
①R离子浓度由大到小的顺序是:__________。
②写出m点反应的而梨子方程式_________________。
③若R溶液改加20mL1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
己知丙烷的燃烧热△H=-2215KJ·mol-1,若一定量的丙烷完全燃烧后生成18g水,则放出的热量约为
A. 55 kJ B.220 kJ C. 550 kJ D.1108 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
食品干燥剂应无毒、无味、无腐蚀性及环境友好。下列说法错误的是
A.硅胶可用作食品干燥剂
B.P2O5不可用作食品干燥剂
C.六水合氯化钙可用作食品干燥剂
D.加工后具有吸水性的植物纤维可用作食品干燥剂
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数,下列叙述正确的是( )
A.常温下,9 g H2O中含NA个O—H键
B.1 mol Fe2+与足量稀硝酸反应,转移3NA个电子
C.常温常压下,22.4 L SO2和O2的混合气体中含2NA个氧原子
D.0.1 mol·L-1KAl(SO4)2溶液中含0.2NA个SO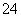
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com