
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按右式进行:Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2 由此可知,该电池充电时在阴极上发生反应的是
Cd(OH)2+2Ni(OH)2 由此可知,该电池充电时在阴极上发生反应的是
A.Ni(OH)2 B.Cd(OH)2 C.Cd D.NiOOH
 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源:2015-2016学年江苏省高一上期中测试化学试卷(解析版) 题型:填空题
(10分)向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式_____________________________。
(2)下列三种情况下,离子方程式与(1)相同的是______(填序号)。
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
若在A项所得溶液中,继续滴加Ba(OH)2溶液,此步反应的离子方程式为: 。
(3)若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用下图1中的 曲线表示(填序号)。
(4)若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如下图2所示,向该烧杯里缓缓注入与Ba(OH)2溶液等密度的稀硫酸至恰好完全反应。在此实验过程中,小球将 。
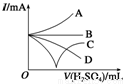

图1 图2
查看答案和解析>>
科目:高中化学 来源:2016届四川省成都市高三上学期期中考试理综化学试卷(解析版) 题型:填空题
(本小题满分14分)
T1温度下,体积为 2L的恒容密闭容器,加入4.00mol X,2.00mol Y,发生化学反应 2X(g)+Y(g)
 3M(g)+N(s) △H<0。部分实验数据如表格所示。
3M(g)+N(s) △H<0。部分实验数据如表格所示。

(1)前500s反应速率v(M)= _____________,该反应的平衡常数K=_____________。
(2)若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是____________(填序号)
A.X的消耗速率与M的消耗速率相等
B.混合气体的平均相对分子质量不变
C.v(Y)与v(M)的比值不变
D.固体的总质量不变
(3)该反应达到平衡时某物理量随温度变化如下图所示。纵坐标可以表示的物理量有哪些_____________。
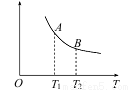
A.Y的逆反应速率
B.M的体积分数
C.混合气体的平均相对分子质量
D.X的质量分数
(4)反应达到平衡后,若再加入3.00molM,3.00molN,下列说法正确的是_____________。
A.平衡不移动
B.重新达平衡后,M的体积分数小于50%
C.重新达平衡后,M的物质的量浓度是原平衡的1.5倍
D.重新达平衡后,Y的平均反应速率与原平衡相等
E.重新达平衡后,用X表示的v(正)比原平衡大
(5)若容器为绝热恒容容器,起始时加入4.00molX,2.00molY,则达平衡后M的物质的量浓度_____________1.5mol/L(填“>”、“=”或“<”),理由是__________________。
查看答案和解析>>
科目:高中化学 来源:2016届吉林省长春市高三上学期质量监测化学试卷(解析版) 题型:选择题
X、Y、M、N是短周期主族元素,且原子序数依次增大。已知X的最外层电子数是电子层数的3倍,X、M同主族,Y的原子在短周期主族元素中原子半径最大。下列说法正确的是
A.X、Y的简单离子半径:r(X2﹣)>r(Y+)
B.Y2X和Y2X2中阴、阳离子的个数比相同,化学键类型也完全相同
C.M与X形成的化合物对应的水化物一定是强酸
D.M的气态氢化物比N的气态氢化物稳定
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省四地六校高二上学期10月联考化学试卷(解析版) 题型:填空题
天然矿物芒硝化学式为Na2SO4·10H2O,为无色晶体,易溶于水。该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念。
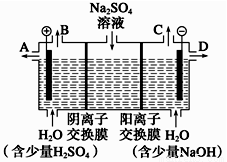
(1)该电解槽的阴极电极反应式为 。此时通过阴离子交换膜的离子数__________(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
(2)所得到的浓氢氧化钠溶液从出口(填“A”、“B”、“C”或“D”)____________导出。
(3)若将制得的氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,则该电池负极的电极反应式为_________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省四地六校高二上学期10月联考化学试卷(解析版) 题型:选择题
已知一定条件下断裂1 mol下列化学键生成气态原子需要吸收的能量如下:H—H 436 kJ;Cl—Cl 243 kJ;H—Cl 431 kJ。下列所得热化学方程式或结论正确的是
A.H(g) + Cl(g) = HCl(g) ΔH=﹣431 kJ·mol-1
B.2HCl(g) = H2(g) + Cl2(g)的反应热ΔH<0
C.H2(g) + Cl2(g) = 2HCl(g) ΔH=﹣183 kJ
D.相同条件下,H2(g)+ Cl2(g) =2HCl(g)反应在光照和点燃条件下的ΔH不相等
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高二上学期第一次段中考试化学试卷(解析版) 题型:选择题
在0.1 mol/L的醋酸钠溶液中加入等体积的下列物质,溶液中离子浓度大小关系正确的是
A.水;c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
B.0.1 mol/L盐酸;c(Na+)=c(Cl-)>c(H+)>c(CH3COO-)>c(OH-)
C.0.1 mol/L醋酸;c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.0.1 mol/L氢氧化钠;c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高二上学期10月月考化学试卷(解析版) 题型:选择题
在密闭容器中将CO和水蒸气的混合物加热到800℃时,有下列平衡:CO(g)+H2O(g) CO2(g)+H2(g),且K=1。若用2molCO和2mol H2O相互混合并加热到800℃,则CO的转化率为
CO2(g)+H2(g),且K=1。若用2molCO和2mol H2O相互混合并加热到800℃,则CO的转化率为
A.16.7% B.50% C.66.7% D.83.3%
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省黄石市高一上学期10月月考化学试卷(解析版) 题型:填空题
为除去粗盐中的CaCl2、MgCl2、FeCl3、Na2SO4 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):

(1)上述实验中第⑤步操作需要烧杯、____________、___________等玻璃仪器。
(2)判断BaCl2已过量的方法是 。
(3)第④步中所有相关的化学方程式是 、 。
(4)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com