
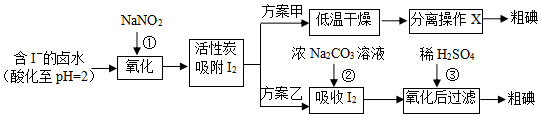
分析 pH=2时,卤亚硝酸钠具有氧化性,碘离子具有还原性,二者发生氧化还原反应①2NO2-+4H++2I-═2NO+I2+2H2O,用活性炭吸附生成的碘单质,通过方案甲低温干燥,升华或加热、冷凝结晶可得粗碘;通过方案乙,用浓碳酸钠溶液吸收碘单质,3I2+3CO32-=5I-+IO3-+3CO2或3I2+6CO32-+3H2O=5I-+IO3-+6HCO3-,再加入稀硫酸,氧化KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O,可得粗碘,据此分析可得.
解答 解:(1)亚硝酸钠具有氧化性,碘离子具有还原性,酸性条件下二者发生氧化还原反应生成一氧化氮和碘和水,离子反应方程式为2NO2-+4H++2I-═2NO+I2+2H2O;
故答案为:2NO2-+4H++2I-═2NO+I2+2H2O;
(2)碘易升华,方案甲中,分离操作X为升华或加热、冷凝结晶;
故答案为:升华或加热、冷凝结晶;
(3)反应②中每吸收3mol I2转移5mol电子,说明生成I-、IO3-,则该离子方程式为:3I2+3CO32-=5I-+IO3-+3CO2或3I2+6CO32-+3H2O=5I-+IO3-+6HCO3-;
故答案为:3I2+3CO32-=5I-+IO3-+3CO2或3I2+6CO32-+3H2O=5I-+IO3-+6HCO3-;
(4)氯气、酸性高锰酸钾等都是常用的强氧化剂,会继续氧化I2,而亚硝酸钠仅能把碘离子氧化为碘单质,故该工艺中氧化卤水中的I-选择了价格较高的NaNO2;
故答案为:氯气、酸性高锰酸钾等都是常用的强氧化剂,会继续氧化I2;
(5)检验滤液中的I-、IO3-,利用碘离子被氧化生成碘单质检验,碘酸根离子被还原生成碘单质检验,方法为:从水层取少量溶液于试管中,加入几滴淀粉溶液,滴加Fe2(SO4)3溶液,振荡,溶液变蓝,说明滤液中含有I-,
另取从水层取少量溶液于试管中,加入几滴淀粉溶液,加硫酸酸化,滴加Na2SO3溶液,振荡,溶液变蓝,说明滤液中含有IO3-;
故答案为:从水层取少量溶液于试管中,加入几滴淀粉溶液,滴加Fe2(SO4)3溶液,振荡,溶液变蓝,说明滤液中含有I-;另取从水层取少量溶液于试管中,加入几滴淀粉溶液,加硫酸酸化,滴加Na2SO3溶液,振荡,溶液变蓝,说明滤液中含有IO3-.
点评 本题考查了碘单质的提取和实验设计,涉及化学方程式的书写,氧化还原反应,资源利用等知识,掌握物质性质及题目信息的利用是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 制取CuSO4:Cu$\stackrel{浓H_{2}SO_{4}、△}{→}$CuSO4 | |
| B. | 制取Cu(NO3)2:Cu$\stackrel{O_{2}、△}{→}$ $\stackrel{HNO_{3}}{→}$Cu(NO3)2 | |
| C. | 制取Al(OH)3:Al$\stackrel{NaOH}{→}$ $\stackrel{H_{2}SO_{4}}{→}$Al(OH)3 | |
| D. | 制取Na2CO3:Na$\stackrel{O_{2}}{→}$ $\stackrel{CO_{2}}{→}$Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li、Na、K | B. | Na、Mg、Al | C. | Li、Be、Mg | D. | Li、Na、Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ③①②④ | C. | ④②③① | D. | ①③②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 起始物质的量 | 甲 | 乙 | 丙 |
| n(H2O)/mol | 0.10 | 0.20 | 0.20 |
| n(CO)/mol | 0.10 | 0.10 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com