
(1)已知:2Fe3++2I-===2Fe2++I2, 2Fe2++Br2===2Fe3++2Br-。
①根据以上方程式比较Fe2+、Br-、I-还原性的强弱
②含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子是________
(2)在硫酸铝、硫酸钾和明矾的1 L混合溶液中,如果SO42-浓度为0.4 mol/L,当加入等体积0.4 mol/L KOH溶液时,生成的沉淀恰好完全溶解,反应后混合溶液中K+的浓度为_______mol/L
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案科目:高中化学 来源:2015-2016学年福建省高一上12月月考化学试卷(解析版) 题型:选择题
下列反应中,调节反应物用量不会改变反应产物的是
A.CO2通入澄清石灰水中
B.稀硝酸中加入铜片
C.稀硝酸中加入铁屑
D.HCl溶液滴入Na2CO3溶液中
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古巴彦淖尔一中高一上期中化学试卷(解析版) 题型:选择题
下列反应能用离子方程式H++OH-==H2O来表示的是
A.H2SO4+Ba(OH)2==BaSO4↓+2H2O
B.2HCl+Ba(OH)2==BaCl2+2H2O
C.H2SO4+Cu(OH)2==CuSO4+2H2O
D.CH3COOH+NaOH == CH3COONa +H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西省高一上12月月考化学试卷(解析版) 题型:选择题
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的阳离子是:

A.Mg2+、Al3+、Fe2+ B.H+、Mg2+、Al3+
C.H+、Ba2+、Al3+ D.只有Mg2+、Al3+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川阆中中学校高一上第二次段考化学试卷(解析版) 题型:推断题
A~G是中学化学中常见的物质,在一定条件下它们之间的转化关系如图所示,其中A为金属,F是一种有毒的气体单质,G为NaOH溶液。
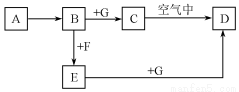
请回答问题。
(1)物质A的化学式是 。
(2)检验E溶液中的金属离子,常选用的试剂是 (填化学式)。
(3)溶液B与气体F反应的离子方程式是 。
(4)物质C转化为物质D的反应中伴随的主要现象是 ,化学方程式是 。
(5)将SO2气体通入BaCl2溶液中无沉淀产生,再将此溶液一分为二,向其中一份中通入足量的氨气,有白色沉淀产生,该沉淀是 (填化学式)。向另一份中滴加几滴E溶液也有白色沉淀产生,请用离子方程式表示该沉淀的产生过程 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年天津静海一中高一上12月学业调研化学卷(解析版) 题型:选择题
向下列液体中滴加稀硫酸,开始时生成沉淀,继续滴加稀H2SO4沉淀又溶解的是
A.Na2CO3溶液 B.BaCl2溶液 C.NaAlO2溶液 D.Fe(OH)3胶体
查看答案和解析>>
科目:高中化学 来源:2016届天津市高三上12月学业调研化学试卷(解析版) 题型:实验题
Ⅰ.(1)某兴趣小组甲设计了以下装置和方法测定空气中SO2含量。你认为可行的操作是 (填序号)
序号 | A | B | C |
装置 |
|
|
|
原理 | 通入V升空气,测定生成沉淀的质量 | 当KMnO4溶液刚好褪色时,测定通入空气的体积V | 通入V升空气,测定U型管增加的质量 |
(2)兴趣小组乙取336mL(标准状况)某由SO2和N2组成的混合气体Y,将其通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由此推知气体Y中SO2的体积分数为 。
Ⅱ某化学兴趣小组丙为探究Fe3+是否能氧化SO2,设计了如下实验装置。
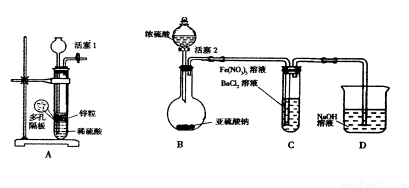
(1)如上图连接好装置。实验前应进行 操作
(2)观察到装置C中产生了白色沉淀,同学们提出了以下猜想(每个猜想只考虑一种物质的氧化性)。
猜想1: ;
猜想2:SO2被Fe3+氧化了;
猜想3:SO2被NO3—氧化了
(3)甲同学认为猜想1正确,并利用上述装置A进行了排除干扰的探究实验。
(4)乙同学认为猜想2正确,则装置C中反应的离子方程式是
(5)丙同学认为猜想3正确,他利用甲同学的实验装置,设计实验验证猜想。请在表格中写出实验步骤以及预期现象和结论。限选实验试剂:NaNO3溶液、KSCN溶液、FeCl3溶液、BaCl2溶液、Fe(NO3)3溶液
实验步骤 | 预期现象和结论 |
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期期末理综化学试卷(解析版) 题型:填空题
开发利用清洁能源具有广阔的开发和应用前景,可减少污染解决雾霾问题。甲醇是一种可再生的清洁能源,一定条件下用CO和H2合成CH3OH:CO(g)+2H2 (g) CH3OH(g) ∆H =-105 kJ·mol-1。向体积为2 L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如下左图中Ⅰ、Ⅱ、Ⅲ曲线所示:
CH3OH(g) ∆H =-105 kJ·mol-1。向体积为2 L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如下左图中Ⅰ、Ⅱ、Ⅲ曲线所示:

(1)①Ⅱ和Ⅰ相比,改变的反应条件是 。
②反应Ⅰ在6 min时达到平衡,在此条件下从反应开始到达到平衡时v (CH3OH) = 。
③反应Ⅱ在2 min时达到平衡,平衡常数K(Ⅱ)= 。在体积和温度不变的条件下,在上述反应达到平衡Ⅱ时,再往容器中加入1 mol CO和3 mol CH3OH后v(正)_______ v (逆)。(填“>”“<”“=”),原因是:_______________________。
④比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1 T3(填“>”“<”“=”),判断的理由是________________________。
(2)某研究所组装的CH3OH﹣O2燃料电池的工作原理如图1所示。
①该电池负极的电极反应式为: 。
②以此电池作电源进行电解,装置如图2所示。发现溶液逐渐变浑浊并有气泡产生,其原因是 (用相关的离子方程式表示)。

查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南师大附属中学高二上二次阶段测化学卷(解析版) 题型:选择题
40℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如下图所示。下列说法不正确的是
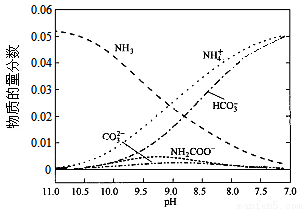
A.在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-)
B.不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-)
C.随着CO2的通入,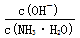 不断增大
不断增大
D.在溶液中pH不断降低的过程中,有含NH2COOˉ的中间产物生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com