
| △c |
| △t |
| 消耗量 |
| 起始量 |
| △n |
| V?△t |
| 0.02mol |
| 2L×20s |
| 0.04 |
| 0.05 |


科目:高中化学 来源: 题型:
| A、断开1个N≡N键的同时有6个N-H键生成 |
| B、混合气体的密度不变 |
| C、混合气体的平均相对分子质量不变 |
| D、N2、H2、NH3分子数之比1:3:2的状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X能形成化学式为X(OH)2的碱 |
| B、X能形成化学式为NaXO2的含氧酸钠盐 |
| C、X原子的最外层电子数和核电荷数不可能为偶数 |
| D、X能与某些金属元素或非金属元素形成化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
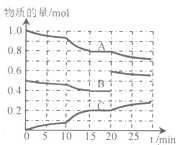 (Ⅰ)在一定条件下,发生反应:
(Ⅰ)在一定条件下,发生反应:| t℃ | 400 | 500 | 800 | 1000 |
| K | 2.6 | 1.6 | 1.0 | 0.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:
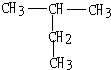 的系统名称为
的系统名称为 的命名为
的命名为查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com