
| 化学键 | C-C | C-H | H-H | C-O | C=O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 750 | 463 |
分析 △H=反应物的总键能-生成物的总键能,该反应中气体的化学计量数之和1+3>1+1,以此来解答.
解答 解:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的焓变△H=750kJ/mol×2+436kJ/mol×3-(413kJ/mol×3+358kJ/mol+463kJ/mol)-463kJ/mol×2=-178kJ/mol;
该反应中气体的化学计量数之和1+3>1+1,混乱度减小,则△S<0,
故答案为:-178kJ/mol;<.
点评 本题考查反应热与焓变,为高频考点,把握焓变与键能的关系、气体的化学计量数与熵变的关系等为解答的关键,侧重分析与应用能力的考查,注意化学键数目的判断,题目难度不大.


科目:高中化学 来源: 题型:实验题
 如图为氯化氢气体的喷泉实验装置.烧杯中的液体是紫色石蕊试液
如图为氯化氢气体的喷泉实验装置.烧杯中的液体是紫色石蕊试液查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳-12的原子符号:12 6C | |
| B. | 次氯酸分子的结构式:H-O-Cl | |
| C. | 硫离子的电子排布式为:1s22s22p63s23p6 | |
| D. | 二氧化硅的分子式:SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
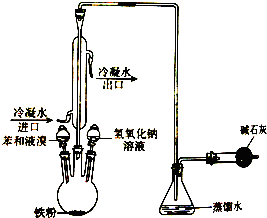 如图是实验室制取溴苯的装置图,请回答下列问题:
如图是实验室制取溴苯的装置图,请回答下列问题:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com