
| A. | 气态氢化物的稳定性:D>W | |
| B. | 四种元素一定属于短周期元素 | |
| C. | 最高价氧化物对应水化物的碱性:L>K | |
| D. | 原子序数:L>K>W>D |
分析 已知aK(n-1)+、bLn+、cWn-、dD(n+1)-具有相同的电子层结构,则有:a-(n-1)=b-n=c+n=d+(n+1),则有K、L在周期表中W、D的下一周期,并且原子序数:b>a>c>d,非金属性越强,氢化物越稳定,金属性越强,最高价氧化物对应水化物的碱性越强,四种元素不一定属于短周期元素,如A为K、B为Ca、C为Cl、D为S也符合,据此解答.
解答 解:已知aK(n-1)+、bLn+、cWn-、dD(n+1)-具有相同的电子层结构,则有:a-(n-1)=b-n=c+n=d+(n+1),则有K、L在周期表中W、D的下一周期,并且原子序数:b>a>c>d.
A.W、D在同一周期,且原子序数W>D,故非金属性:W>D,则气态氢化物的稳定性:W>D,故A错误;
B.四种元素不一定属于短周期元素,如A为K、B为Ca、C为Cl、D为S也符合,故B错误;
C.K、L在周期表中同周期,原子序数:b>a,金属性:K>L,最高价氧化物对应水化物的碱性:K>L,故C错误;
D.aK(n-1)+、bLn+、cWn-、dD(n+1)-具有相同的电子层结构,则有:a-(n-1)=b-n=c+n=d+(n+1),故原子序数:b>a>c>d,故D正确,
故选D.
点评 本题考查位置结构性质的相互关系及应用,根据核外电子排布确定元素所在周期表中的位置以及把握元素周期律的递变规律是解答该题的关键,难度不大.


科目:高中化学 来源: 题型:选择题
| 物质性质 | 甲 | 乙 | 丙 | 丁 |
| 熔点 | 低 | 高 | 高 | 低 |
| 水溶性 | 不溶 | 溶 | 不溶 | 溶 |
| 高温 | 分解 | 稳定 | 稳定 | 稳定 |
| 导电性 | 不导电 | 导电 | 不导电 | 导电 |
| A. | 甲 | B. | 乙 | C. | 丙 | D. | 丁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如图所示,则下列说法错误的是( )
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如图所示,则下列说法错误的是( )| A. | 反应的化学方程式是X+2Y?2Z | |
| B. | 该反应在0-3min时间内产物Z的平均反应速率 0.083mol•L-1•min-1 | |
| C. | 该反应达到平衡时反应物X的转化率α等于45% | |
| D. | 其他条件不变,升高温度,若正反应速率增大,则逆反应速率将减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
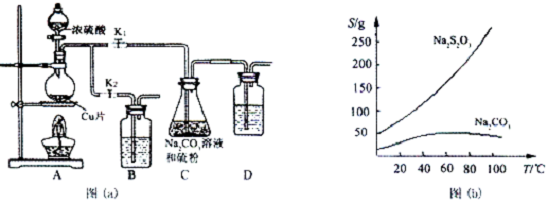
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂与还原剂的物质的量之比为2:1 | |
| B. | 氧化产物与还原产物的物质的量之比为1:1 | |
| C. | 该反应说明Cu的金属性很强 | |
| D. | 2mol H2SO4参与反应时,有4 mol电子发生转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||
| Y | ||
| Z |
| A. | X是活泼非金属元素,其最高价氧化物的水化物是一种强酸 | |
| B. | Y是活泼非金属元素,其最高价氧化物的水化物是一种强酸 | |
| C. | Z是较活泼的非金属元素,其最高价氧化物的水化物是一种强酸 | |
| D. | Y单质的氧化性比Z单质的氧化性弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com