
| A.白磷比红磷稳定 |
| B.红磷转变为白磷是吸热反应 |
| C.红磷燃烧的热化学方程式:4P(s)+5O2(g)→P4O10(s)+E3-E2 |
| D.白磷燃烧是吸热反应 |

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
| A.化学反应中化学键的断裂和形成是反应过程中有能量变化的本质原因 | ||
| B.常温常压下,用惰性电极电解500mL饱和氯化钠溶液时,若溶液的pH变为13时,则可产生的气体体积为2.24L | ||
| C.NaHSO4溶液与Ba(OH)2溶液反应至中性的离子方程式为:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | ||
D.在保持常温下,向醋酸溶液中不断加入CH3COONa固体至溶液的PH=7,则醋酸的电离度减小,
|
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.等物质的量的硫蒸气和硫粉分别完全燃烧,后者放出热量多 |
| B.由C(石墨)=C(金刚石)△H=+1.9kJ/mol可知,金刚石比石墨稳定 |
| C.根据热化学方程式:S(s)+O2(g)=SO2(g)△H=-297.23kJ/mol,可推知1molSO2(g)的能量总和大于1moS(s)和1molO2(g)的能量总和 |
| D.根据稀溶液中反应:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol;若将含0.5molH2SO4的浓硫酸与含lmolNaOH的稀溶液混合时,放出的热量大于57.3kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
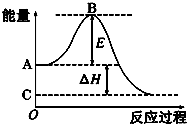
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| ||
| A.该反应是一个放热反应 |
| B.参加反应的氢气和氧气的总能量高于反应生成的水的总能量 |
| C.水分解为氢气和氧气需要吸收能量 |
| D.断键所吸收的总能量高于成键所放出的能量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.稀醋酸与稀氢氧化钠溶液发生中和反应的热化学方程式为:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.3kJ/mol |
| B.在101kPa时1mol物质燃烧时的反应热叫做该物质的燃烧热 |
| C.未来氢气作为新能源的其中一个优点是充分燃烧的产物不污染环境 |
| D.升高温度或加入催化剂,可以改变化学反应的反应热 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
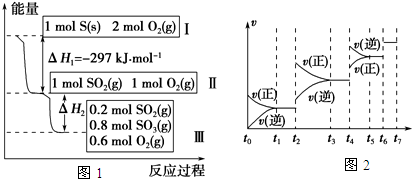
| t1-t2 | t3-t4 | t5-t6 | t6-t7 |
| K1 | K2 | K3 | K4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com