


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
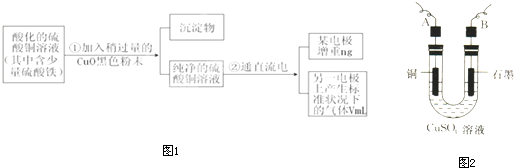
| ||
| ||
| 11200 |
| V |
| 11200 |
| V |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 实验操作 | 实验现象 |
| 打开弹簧夹,通入一段时间CO2,关闭弹簧夹. | |
| 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞. | 无明显现象. |
| 加热烧瓶,反应开始后停止加热. | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅; B中溶液变棕色; C中溶液紫色变浅. ②反应停止后,A中无固体剩余. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作、现象 | 解释或结论 |
| A.铝箔在酒精灯火焰上加热,熔化但不滴落 | 铝箔对熔化的铝有吸附作用 |
| B.向盛有0.005mol/L FeCl3溶液的试管中加入5mL 0.01mol/LKSCN溶液,溶液呈红色,再加入5滴饱和FeCl3溶液,红色加深 | 增大反应物的浓度,化学平衡向正反应方向移动 |
| C.证明Mg(OH)2沉淀可以转化为Fe(OH)3 沉淀 |
向2mL 1mol/L NaOH溶液中先加入3滴1mol/L MgCl2溶液,再加入3滴1mol/L FeCl3溶液 |
| D.取某溶液少量,加入盐酸酸化的硝酸钡溶液,出现白色沉淀 | 该溶液中一定含有大量的SO42- |
| A、铝箔在酒精灯火焰上加热,熔化但不滴落 |
| B、向盛有0.005mol/L FeCl3溶液的试管中加入5mL 0.01mol/LKSCN溶液,溶液呈红色,再加入5滴饱和FeCl3溶液,红色加深 |
| C、证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 |
| D、取某溶液少量,加入盐酸酸化的硝酸钡溶液,出现白色沉淀 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年天津市高三毕业班联考(一)理综化学试卷(解析版) 题型:选择题
下列实验操作、现象或反应原理的解释、结论均正确的一组是
操作、现象 解释或结论
A.铝箔在酒精灯火焰上加热,熔化但不滴落 铝箔对熔化的铝有吸附作用
B.向盛有0.005mol/L FeCl3溶液的试管中加入5mL 0.01mol/LKSCN溶液,溶液呈红色,再加入5滴饱和FeCl3溶液,红色加深 增大反应物的浓度,化学平衡向正反应方向移动
C.向淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的氢氧化铜悬浊液并加热,未见红色沉淀 淀粉未水解
D.取某溶液少量,加入盐酸酸化的硝酸钡溶液,出现白色沉淀 该溶液中一定含有大量的SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(Ⅰ)下列实验操作或对实验事实的描述正确的是 (填序号);
① 实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉。
② 配制一定浓度的溶液时,俯视容量瓶的刻度线,会使配制的浓度偏高;实验室测定中和热时,过早读数会使测定结果偏低。
③ 将Fe2(SO4)3溶液加热蒸发至干并灼烧,最后得到红棕色粉末
④ 实验室用铜片与稀硝酸反应产生的气体可用排水法收集
⑤ 试管中加入少量淀粉,再加入一定量稀硫酸,加热3-4分钟,然后加入银氨溶液,片刻后管壁上有“银镜”出现
⑥ 向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水现象相同
⑦ 苯与溴水在铁粉的催化作用下制备溴苯
⑧ 分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多
Ⅱ.在中学化学实验中,通常用无水硫酸铜来检验少量水的存在。由于无水硫酸铜吸湿性很强,需要现制现用。
方法甲:取2药匙细小的硫酸铜晶体置于_______中研碎后放入坩埚,将坩埚放在______上用小火慢慢加热并用玻璃棒不停搅拌,最后将坩埚移入___________中进行冷却(请选用合适仪器填空:表面皿、研钵、烧杯、通风橱、试管夹、干燥器、泥三角)。
方法乙:取2药匙研碎的硫酸铜晶体于小烧杯中,加入20 mL浓硫酸(质量分数不低于98%),并用玻璃棒搅拌,静置5 min后倾去浓硫酸,用无水乙醇洗涤数次,倒在滤纸上晾干。
【交流与讨论】
(1)方法甲中,加热温度稍高时会出现变黑现象,原因是_________(用化学方程式表示)。
(2)方法乙中,浓硫酸的作用是__________;为了不浪费药品,对无水乙醇洗涤液进行再生的方法是______ ,所用的主要玻璃仪器有烧瓶、接液管、锥形瓶、酒精灯________________等。
(3)用制得的无水硫酸铜检验某双氧水中是否含水时,除了发现固体变蓝外,还发现该双氧水中有气泡产生,对此你有何猜想______________。
 (4)目前工业上正积极探索用浓HNO3作氧化剂,用Cu与浓H2SO4、浓HNO3反应,采取间歇加热、逐渐加入浓HNO3的方法来制备CuSO4•5H2O的新工艺。模拟制备装置如下图所示。
(4)目前工业上正积极探索用浓HNO3作氧化剂,用Cu与浓H2SO4、浓HNO3反应,采取间歇加热、逐渐加入浓HNO3的方法来制备CuSO4•5H2O的新工艺。模拟制备装置如下图所示。
【问题一】如图装置中,分液漏斗内装的液体是________,反应结束时,获取CuSO4•5H2O的操作过程是先________________,趁热将三颈瓶中的液体倒入烧杯中冷却,析出晶体CuSO4?5H2O ,过滤、晾干。
【问题二】工业上用石灰乳吸收尾气,除了防止环境污染外,还能得到了有经济实用价值的副产品―― 亚硝酸钙。尾气吸收生成亚硝酸钙的化学方程式是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com