
【题目】有等体积、等pH的Ba(OH)2、KOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是( )
A.V3>V2>V1 B.V3=V2=V1 C.V3>V2=V1 D.V1=V2>V3
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】“群众利益无小事,食品安全是大事”。下列作法不会导致食品对人体健康有害的是
A.用干冰保藏易变质的食品。
B.用硫磺熏制白木耳、粉丝等食品。
C.用甲醛浸泡易腐烂的食品。
D.用含亚硝酸钠的工业用盐腌制食品。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关组成生物体化学元素的论述中,正确的是( )
A. 非生物界的元素在生物界都能找到,说明生物界和非生物界具有统一性
B. 人、动物与植物中所含的化学元素种类差异很大
C. 划分大量元素和微量元素的标准是元素的含量
D. 不同生物体内各种化学元素的含量比例基本相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极上通入乙烷和氧气,其电极反应式为:C2H6+18OH- –14e-→2CO![]() +12H2O、7H2O+7/2O2+14e-→14OH-,有关此电池的推断正确的是( )
+12H2O、7H2O+7/2O2+14e-→14OH-,有关此电池的推断正确的是( )
A.通氧气的电极为负极
B.参加反应的氧气与C2H6的物质的量之比为7∶2
C.放电一段时间后,KOH的物质的量浓度不变
D.电解质溶液中,CO![]() 向正极移动
向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡CH3COOH![]() H++CH3COO-,下列叙述正确的是( )
H++CH3COO-,下列叙述正确的是( )
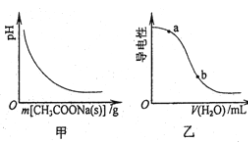
A.图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
B.图乙表示向CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b
C.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
D.0.10mol·L-1的CH3COOH溶液中加水稀释,溶液中c(OH-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【选修3:物质结构与性质】有A、B、C、D 四种元素,其中 A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p 轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D 的质量分数为40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A+与D2-离子数之比为 2∶1。请回答下列问题:
(1)A元素形成的晶体内晶胞类型应属于___________(填写“六方” 、 “面心立方” 或“体心立方”)堆积,空间利用率为____________。
(2)C3-的电子排布式为__________,在CB3分子中C元素原子的原子轨道发生杂化,CB3分子的VSEPR模型为_________。
(3)C的氢化物极易溶于水,请解释原因__________________。
(4)D元素与同周期相邻元素的第一电离能由大到小的关系是________________(用元素符号表示);用一个化学方程式说明 B、D两元素形成的单质的氧化性强弱:____________________。
(5)如图所示是R形成的晶体的晶胞,该晶胞与 CaF2晶胞结构相似,设晶体密度是 ρ g·cm-3。R晶体中A+和D2-最短的距离为____________cm。(阿伏加德罗常数用 NA表示,只写出计算式,不用计算)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热化学方程式的书写。
①已知0.4mol液态肼(N2H4)和足量H2O2反应,生成氮气和水蒸气时放出256.65kJ的热量.写出该反应的热化学方程式: 。
②已知化学方程式:H2(g)+O2(g)=![]() H2O(g),该反应的活化能为167.2kJ/mol,其逆反应的活化能为409.0kJ/mol,写出该反应的热化学方程式: 。
H2O(g),该反应的活化能为167.2kJ/mol,其逆反应的活化能为409.0kJ/mol,写出该反应的热化学方程式: 。
③已知白磷(P4)和PCl3的分子结构如图所示,现提供以下的化学键的键能(KJ/mol):P-P 198,Cl-Cl 243, P-Cl 331。则写出1mol白磷完全反应生成PCl3(s)时的热化学方程式:_____________.

④已知S(s)+O2(g)![]() SO2(g)当有4NA个电子转移时,放出297.23kJ的热量.写出该反应的热化学方程式 .
SO2(g)当有4NA个电子转移时,放出297.23kJ的热量.写出该反应的热化学方程式 .
⑤常温常压下,1克CH4完全燃烧生成CO2和H2O时,放出Q kJ的热量.写出此反应的热化学方程式: 。
⑥酒精燃烧的化学方程式为:C2H6O(l)+3O2(g)=2CO2(g)+3H2O(l),完全燃烧一定量的无水酒精,放出的热量为Q kJ,当完全吸收生成的CO2,消耗8mol/L的NaOH溶液50mL时恰好生成正盐.写出此反应的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用下图表示。

(1)海洋中的氮循环起始于氮的固定,其中属于固氮作用的一步是 (填图中数字序号)。
(2)下列关于海洋氮循环的说法正确的是 (填字母序号)。
a. 海洋中的氮循环起始于氮的氧化
b. 海洋中存在游离态的氮
c. 向海洋排放含NO3-的废水会影响海洋中NH4+的含量
d. 海洋中的反硝化作用一定有氧气的参与
(3)有氧时,在硝化细菌作用下,NH4+可实现过程④的转化,将离子方程式补充完整:
![]() NH4++5O2
NH4++5O2![]() 2NO2-+
2NO2-+![]() H++
H++![]() +
+![]()
(4)有人研究了温度对海洋硝化细菌去除氨氮效果的影响,下表为对10 L人工海水样本的监测数据:
温度/℃ | 样本氨氮含量/mg | 处理24 h | 处理48 h |
氨氮含量/mg | 氨氮含量/mg | ||
20 | 1008 | 838 | 788 |
25 | 1008 | 757 | 468 |
30 | 1008 | 798 | 600 |
40 | 1008 | 977 | 910 |
硝化细菌去除氨氮的最佳反应温度是 ,在最佳反应温度时,48 h内去除氨氮反应的平均速率是 mg·L-1·h-1。
(5)为了避免含氮废水对海洋氮循环系统的影响,需经处理后排放。如图是间接氧化工业废水中氨氮(NH4+)的示意图。

结合电极反应式简述间接氧化法去除氨氮的原理: 。
若生成H2和N2的物质的量之比为3:1,则处理后废水的pH将 (填“增大”、“不变”或“减小”),请简述理由: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com