
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.①③⑤ | C.②④⑤ | D.③⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.负极反应为Zn2++2e-="Zn" | B.Cu电极上产生无色无味气泡 |
| C.正极反应是Cu2++2e-=Cu | D.溶液慢慢变成蓝色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.F2和Br2的沸点 |
| B.H-和Be2+的离子半径 |
| C.同温下分别在100g水中最多能溶解的无水CuSO4的质量和CuSO4·5H2O的质量 |
| D.在NH3+NO → N2+H2O反应中,被氧化和被还原的N原子数 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
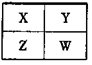
| A.W的原子序数可能是Y的原子序数的2倍 |
| B.Z元素的原子半径可能比Y元素的小 |
| C.W的气态氢化物的稳定性一定比Y的强 |
| D.若Z的最高正价为+m, 则X的最高正价也一定为+m |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 (1)写出Si的基态原子价电子排布式 。
(1)写出Si的基态原子价电子排布式 。 (2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为 ,微粒间存在的作用力是 。
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为 ,微粒间存在的作用力是 。 (4)SO2、NO2、H2S同属于 结构(填“三角锥形”、“直线型”或“V字型”)。从微观结构角度分析,其中一种分子又与另二种分子有不同之处,该分子的化学式是 。
(4)SO2、NO2、H2S同属于 结构(填“三角锥形”、“直线型”或“V字型”)。从微观结构角度分析,其中一种分子又与另二种分子有不同之处,该分子的化学式是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.lH、2H、3H为同素异形体 | B.lH、2H、3H互为同位素 |
| C.lH、2H、3H的中子数相同 | D.lH、2H、3H为同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com