
分析 X的单质在Z的单质中燃烧,生成XZ,燃烧时火焰呈苍白色,XZ的水溶液可使石蕊试液变红,说明X为H,Z为Cl,XZ为HCl,两分子X的单质可与一分子Y的单质化合生成两分子X2Y,X2Y常温下为液体,说明Y为O,X2Y为H2O,Cl2溶于H2O中,反应生成HCl和HClO,HClO具有漂白作用.
解答 解:(1)X的单质在Z的单质中燃烧,生成XZ,燃烧时火焰呈苍白色,XZ的水溶液可使石蕊试液变红,说明X为H,Z为Cl,XZ为HCl,两分子X的单质可与一分子Y的单质化合生成两分子X2Y,X2Y常温下为液体,说明Y为O,X2Y为H2O,Cl2溶于H2O中,反应生成HCl和HClO,HClO具有漂白作用.
故答案为:H;O;Cl;
(2)⑤的反应方程式:Cl2+H2O=HCl+HClO,故答案为:Cl2+H2O=HCl+HClO;
(3)工业上电解饱和氯化钠溶液生成氯气,化学方程式:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,故答案为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
点评 本题考查物质的推断以及氯气性质,根据信息中“火焰呈苍白色”、“Z的单质溶于X2Y中所得溶液具有漂白作用”、“X2Y常温下为液体”进行推断,题目难度不大,注意氯气的性质的积累.


科目:高中化学 来源: 题型:解答题
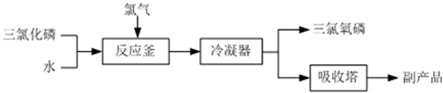
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

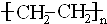 ;②C→D:CH3COOH+CH3CH2OH
;②C→D:CH3COOH+CH3CH2OH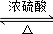 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 影响化学反应速率的因素与化学物质本身无关 | |
| B. | 反应物颗粒越小,其表面积就越小,化学反应速率就越慢 | |
| C. | 加入催化剂一定能够加快化学反应速率 | |
| D. | 增大反应物的浓度和升高反应物的温度都可以加快化学反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质组别 | 甲 | 乙 | 丙 |
| A | NH3 | O2 | HNO3 |
| B | Al | HCl | NaOH |
| C | SiO2 | NaOH | HCl |
| D | CO2 | Ca(OH)2 | NaHSO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高一上第一次月考化学卷(解析版) 题型:填空题
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中的信息,回答下列问题 :
溶质的物质的量浓度/ | 溶液的密度/ |
| |
硫酸 |
|
| |
氨水 |
|
|
(1)表中硫酸的质量分数为__________(不写单位,用含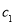 、
、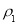 的代数式表示)。
的代数式表示)。
(2)物质的量浓度为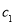
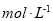 的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为___________
的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为___________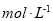 。
。
(3)物质的量浓度为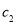
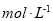 的氨水与
的氨水与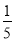
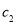
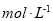 的氨水等质量混合,所得溶液的密度______(填
的氨水等质量混合,所得溶液的密度______(填
“大于”、“小于”或“等于”,下同) 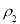
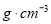 ,所得溶液的物质的量浓度________
,所得溶液的物质的量浓度________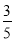
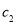
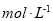
(设混合后溶液的体积变化忽略不计)
(4)若将稀硫酸与氨水混合,写出其反应的离子方程式___________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com