


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
A、试液
| ||||||||
B、试液
| ||||||||
C、试液
| ||||||||
D、试液
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 NH4Al(SO4)2是加工食品最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业有广泛应用.试回答下列问题:
NH4Al(SO4)2是加工食品最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业有广泛应用.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、异戊二烯与等物质的量的溴发生加成反应 |
| B、邻羟基苯甲酸与小苏打溶液反应 |
| C、甲苯在一定条件下发生硝化反应生成一硝基甲苯的反应 |
| D、2-氯丁烷[CH3CH(Cl)CH2CH3]与氢氧化钠乙醇溶液共热消去HCl分子的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
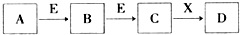 由短周期元素组成中学常见物质A、B、C、D、E、X,存在如图转化关系((部分生成物和反应条件略去).下列推断不正确的是( )
由短周期元素组成中学常见物质A、B、C、D、E、X,存在如图转化关系((部分生成物和反应条件略去).下列推断不正确的是( )| A、若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C |
| B、若D是一种强碱,则A、B、C均可与X反应生成D |
| C、若D为NaCl,且A可与C反应生成B,则E可能是CO2 |
| D、若D与盐酸反应,则X一定是H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c (CH3COO-)>c (Na+) |
| B、c (OH-)>c (H+) |
| C、c (CH3COOH)>c (CH3COO-) |
| D、c (CH3COOH)+c (CH3COO-)=0.02mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 性质 元素 | 8O | 16S | 34Se | 52Te |
| 单质溶点(°C) | -218.4 | 113 | 450 | |
| 单质沸点(°C) | -183 | 444.6 | 685 | 989 |
| 主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com