
����Ŀ���������ƴ�������Ⱦ�Ϻ��л��ϳɹ�ҵ����ľм�Ʊ��������Ƶ�������ͼ1�� 
��֪���������У����Ʒ�ӦҺ���¶���55��60�������·�������Ҫ��ӦΪ��C6H12O6+12HNO3�T3H2C2O4+9NO2��+3NO��+9H2O
��1�����ܹ����У������������ �� ������ɺ�����Һ����Ũ������ȴ�ᾧ�����ˡ�ϴ�ӵõ���ɫ��״���������ƣ�
��2��ʵ����ģ�����������չ��̵�װ����ͼ2��ʾ��Aװ������Ʒ�ӦҺ���¶Ȳ�����60���ԭ������Bװ�������Ʊ��������ƣ�����ʢ�ŵ���Һ��������ĸ���� 
a��NaCl��Һb��Na2CO3��Һc��NaNO3��Һ
��3����ҵ�������չ����������NO��NO2�����ʵ����Ƚӽ�1��1������NO����n��NO2����1��1����ᵼ������n��NO����n��NO2����1��1��ʹ��Ʒ�л��е�����Ϊ ��
��4����֪NaNO2�ܰ����������µ�Fe2+������ͬʱ����һ���ж������壬��д���÷�Ӧ�����ӷ���ʽ�� ��
��5����֪����NaNO2�������ԣ��������������ܰ�I������ΪI2��S2O32�����ܰ�I2��ԭΪI�� �� ��NaNO2Ҳ�л�ԭ�ԣ���ʹ����KMnO4��Һ��ɫ��Ϊ�ⶨ��ƷNaNO2�Ĵ��ȣ��벹������ʵ�鷽����ȷ����������NaNO2��Ʒ������ƿ�У�������ˮ�ܽ⣬ �� ʵ���пɹ�ѡ����Լ���ϡ���ᡢc1 molL��1 KI��Һ��������Һ��c2 molL��1 Na2S2O3��Һ��c3 molL��1����KMnO4��Һ��
���𰸡�
��1��������ʹ��ά��ˮ���Ϊ������
��2���¶ȹ��ᵼ��HNO3�ֽ⣬����NaNO2�IJ��ʣ�b
��3���ŷ�������NO�������ߣ�NaNO3
��4��NO2��+2H++Fe2+=NO��+Fe3++H2O
��5��Ȼ����c3mol?L��1����KMnO4��Һ�ζ�����Һ����ɫǡ�ñ�Ϊdz��ɫ���Ұ�����ڲ���ɫ���������ظ����ϲ���2��3��
���������⣺��1�����ܹ����У�����������Ǵ��������Դ��ǣ�������ʹ��ά��ˮ���Ϊ�����ǣ���2�������ֽ⣬��Aװ������Ʒ�ӦҺ���¶Ȳ�����60���ԭ�����¶ȹ��ᵼ������ķֽ⣬ʹNaNO2���ʽ��ͣ���Ӧ�в�����NO2��NO��̼������Һ���ռ�ת��Ϊ�������ƣ����Դ��ǣ��¶ȹ��ᵼ������ķֽ⣬ʹNaNO2���ʽ��ͣ�b����3��NO��NO2�����ʵ�����=1��1ʱǡ�ÿ��Կ��������ᣬ�������NO����n��NO2����1��1����ᵼ���ŷ�������NO�������ߣ���n��NO����n��NO2����1��1ʱNO2���������ֻ���������ƣ�����ʹ��Ʒ�л��е�����ΪNaNO3 �� ���Դ��ǣ��ŷ�������NO�������ߣ�NaNO3��4����֪NaNO2�ܰ����������µ�Fe2+������˵����Ԫ�صĻ��ϼ۽��ͣ�ͬʱ����һ���ж������壬��˸�������NO�����Ը÷�Ӧ�����ӷ���ʽΪNO2��+2H++Fe2+=NO��+Fe3++H2O�����Դ��ǣ�NO2��+2H++Fe2+=NO��+Fe3++H2O����5������NaNO2�л�ԭ�ԣ���ʹ����KMnO4��Һ��ɫ�����Կ���ͨ��������ԭ�ζ��ⶨ�䴿�ȣ����ʵ�鷽�����Ϊ��ȷ����������NaNO2��Ʒ������ƿ�У�������ˮ�ܽ⣬Ȼ����c3molL��1����KMnO4��Һ�ζ�����Һ����ɫǡ�ñ�Ϊdz��ɫ���Ұ�����ڲ���ɫ���������ظ����ϲ���2��3�Σ� ���Դ��ǣ�Ȼ����c3molL��1����KMnO4��Һ�ζ�����Һ����ɫǡ�ñ�Ϊdz��ɫ���Ұ�����ڲ���ɫ���������ظ����ϲ���2��3�Σ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪2A2��g��+B2��g��2C3��g������H=��Q1 kJ/mol��Q1��0������һ���д������ݻ�������ܱ������м���2molA2��1molB2 �� ��500��ʱ��ַ�Ӧ����ƽ���C3��Ũ��Ϊw molL��1 �� �ų�����ΪQ2 kJ��
��1���ﵽƽ��ʱ��A2��ת����Ϊ ��
��2���ﵽƽ�������ԭ������ͨ�������������A2��ת���ʽ������������С�����䡱��
��3������ԭ���������У�ֻ����2mol C3 �� 500��ʱ��ַ�Ӧ��ƽ�����������Q3 kJ��C3Ũ�������=������w molL��1 �� Q1��Q2��Q3 ֮��������ֹ�ϵ��Q3=
��4���ı�ijһ�������õ���ͼ�ı仯���ɣ�ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ��������ɵó��Ľ�����ȷ������ 
a����Ӧ����c��b��a
b���ﵽƽ��ʱA2��ת���ʴ�СΪ��b��a��c
c��T2��T1
d��b��A2��B2�����ʵ���֮��Ϊ2��1
��5����������������Ϊ��ѹ����������ʼʱ����4molA2��2molB2 �� 500��ʱ��ַ�Ӧ��ƽ��ų�����Q4kJ����Q2Q4 �����������������=������
��6�����д�ʩ����ͬʱ��߷�Ӧ���ʺ�B2��ת����������ѡ����ţ��� a��ѡ���ʵ��Ĵ��� b������ѹǿ c����ʱ�������ɵ�C3 d�������¶ȣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���¶�ΪTʱ����2.0L�����ܱ������г���1.0mol PCl5����ӦPCl5��g��PCl3��g��+Cl2��g������һ��ʱ���ﵽƽ�⣮��Ӧ�����вⶨ�IJ������ݼ�����
t/s | 0 | 50 | 150 | 250 | 350 |
n��PCl3��/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
����˵����ȷ���ǣ� ��
A.��Ӧ��ǰ50 s��ƽ������v��PCl3��=0.003 2 molL��1s��1
B.���������������䣻�����¶ȣ�ƽ��ʱc��PCl3��=0.11 molL��1����Ӧ�ġ�H��0
C.��ͬ�¶��£���ʼʱ�������г���1.0 mol PCl5��0.20 mol PCl3��0.20 mol Cl2����Ӧ�ﵽƽ��ǰv��������v���棩
D.��ͬ�¶��£���ʼʱ�������г���2.0 mol PCl3��2.0 mol Cl2���ﵽƽ��ʱ��PCl3��ת����С��80%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���Ӫ�����ʵ�˵���������
A. ���ǡ����Ǻ���ѿ�Ǿ�Ϊ˫��
B. ��ø��һ����и�ѡ������ܵĵ�����
C. ֲ���ͺ�������֬����������ʹBr2/CCl4��ɫ
D. ���ۺ���ά��ˮ������ղ����Ϊ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�п��ܺ��е��������±���ʾ��
���ܴ������е������� | H+��Mg2+��Al3+��NH4+��Fe3+ |
���ܴ������е������� | Cl-��NO3-��SO42-��CO32-��AlO2- |
Ϊ̽����ɷ֣�������̽��ʵ�顣ȡһ��������Һ����������μ�������������Һ���������������ʵ���(n)���������������Һ�������V���Ĺ�ϵ��ͼ��ʾ��

��1������Һ��һ�������ڵ���������_____________
��2������Һ��һ�������ڵ���������_____________
��3������Һ�к��е����������Ӧ�����ʵ���Ũ��֮��Ϊ____________________________
��4��д���������ٹ����з�����Ӧ�����ӷ���ʽ____________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪AΪ�������ʣ�����֮���ܷ������·�Ӧ�����ֲ���δ�����

�����������Ϣ�ش��������⣺
��1��д������B�Ļ�ѧʽ��___________
��2��д�����з�Ӧ�Ļ�ѧ����ʽ��
��Ӧ��______________________________________________________________________
��Ӧ��______________________________________________________________________
��3��д�����з�Ӧ�����ӷ���ʽ��
��ӦC��D______________________________________________________________________
��ӦD��C _____________________________________________________________________
��4������D�������ӵķ����� _________________________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�ij��Ӧ��ƽ�⣬ƽ�ⳣ�� ![]() ������ʱ���¶����ߣ�H2Ũ�ȼ�С������˵����ȷ���ǣ� ��
������ʱ���¶����ߣ�H2Ũ�ȼ�С������˵����ȷ���ǣ� ��
A.�÷�Ӧ���ʱ�Ϊ��ֵ
B.���º����£�����ѹǿ��H2Ũ��һ����С
C.�����¶ȣ��淴Ӧ���ʼ�С
D.�÷�Ӧ�Ļ�ѧ����ʽΪCO+H2OCO2+H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ΪV L�ĺ����ܱ�������ʢ��һ����H2 �� ͨ��Br2��g��������ӦH2��g��+Br2��g��2HBr��g����H��0�����¶ȷֱ�ΪT1��T2 �� ƽ��ʱ��H2�����������Br2��g�������ʵ����仯��ϵ��ͼ��ʾ������˵����ȷ���ǣ� �� 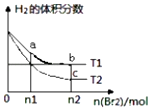
A.��b��c�����ƽ�ⳣ���ֱ�ΪK1��K2 �� ��K1��K2
B.a��b����ķ�Ӧ���ʣ�b��a
C.Ϊ�����Br2��g����ת���ʿɲ�ȡ����Br2��g��ͨ�����ķ���
D.b��c�����HBr���������b��c
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com