
【题目】I.汽车内燃机工作时会引起N2和O2的反应:N2+O2![]() 2NO,是导致汽车尾气中含有NO的原因之一。
2NO,是导致汽车尾气中含有NO的原因之一。
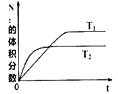
(1)在T1、T2温度下,一定量的NO发生分解反应时N2 的体积分数随时间变化如图所示,根据图像判断反应N2(g)+O2(g)![]() 2NO(g)的△H_____0(填“>"或“<”)。
2NO(g)的△H_____0(填“>"或“<”)。
(2)在T3温度下,向2L密闭容器中充入10molN2与5molO2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率v(N2)_________。
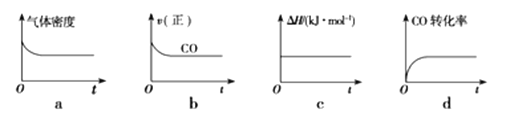
II.(3)金属镍具有优良的物理和化学特性,是高技术产业的重要原料。羰基法提纯镍涉及的反应为:Ni(s)+4CO(g)![]() Ni(CO)4(g)△H<0,一定温度下,将一定量的粗镍和CO加入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是___(填字母)
Ni(CO)4(g)△H<0,一定温度下,将一定量的粗镍和CO加入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是___(填字母)
Ⅲ.甲烷和甲醇可以做燃料电池,具有广阔的开发和应用前景,回答下列问题
(4)甲醇燃料电池(简称DMFC )由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如下图所示:
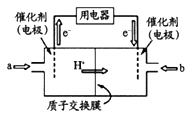
通入a气体的电极是原电池的___极(填“正”或“负”),其电极反应式为_________。
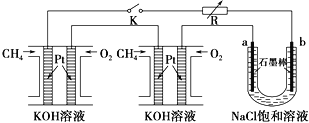
(5)某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示U形管中氯化钠溶液的体积为800ml。闭合K后,若每个电池甲烷用量为0.224L (标况),且反应完全,则理论上通过电解池的电量为____(法拉第常数F=9.65×104C/mol),若产生的气体全部逸出,电解后溶液混合均匀,电解后U形管中溶液的pH为_________。
【答案】 > 0.01mol/(L.s) bd 负 CH3OH-6e-+H2O=CO2+6H+ 7.72×103 c 13
【解析】(1)根据题给图像知,温度为T2时先达到平衡状态,说明温度为T2时反应速率快,故温度:T1<T2,但温度为T2时反应达平衡时氮气的体积分数低,说明升高温度平衡向正反应方向进行,正方应是吸热反应,即△H>0。(2)50秒后达到平衡,测得NO的物质的量为2mol,根据方程式可知消耗氮气是1mol,则该反应的速率v(N2)根据公式v=△n/V△t将题给数据代入计算得υ(N2)=![]() =0.01 mol·L-1·s-1;(3)一定温度下,将一定量的粗镍和CO加入一恒压密闭容器中,a.随着反应的进行,容器内气体的质量增大,物质的量减小,等压条件下容器体积减小,密度逐渐增大,达平衡时密度不变,与图像不符,a错误;b.随着反应的减小,反应物的浓度逐渐减小,正反应速率逐渐减小,达平衡时正反应速率不变,与图像符合,b正确;c. △H不随反应的进行而变化,不能作为平衡标志,c错误;d.CO的转化率随反应的进行不断增大,达平衡时CO的转化率不变,与图像相符,d正确,答案选bd;(4)燃料电池中,通入燃料的电极为负极,发生氧化反应。根据装置图可知左侧是电子流出的一极,所以通入a气体的电极是原电池的负极。由于存在质子交换膜,所以甲醇被氧化生成二氧化碳,电极方程式为CH3OH-6e-+H2O=CO2↑+6H+;(5)电解氯化钠溶液的化学方程式为2NaCl+2H2O
=0.01 mol·L-1·s-1;(3)一定温度下,将一定量的粗镍和CO加入一恒压密闭容器中,a.随着反应的进行,容器内气体的质量增大,物质的量减小,等压条件下容器体积减小,密度逐渐增大,达平衡时密度不变,与图像不符,a错误;b.随着反应的减小,反应物的浓度逐渐减小,正反应速率逐渐减小,达平衡时正反应速率不变,与图像符合,b正确;c. △H不随反应的进行而变化,不能作为平衡标志,c错误;d.CO的转化率随反应的进行不断增大,达平衡时CO的转化率不变,与图像相符,d正确,答案选bd;(4)燃料电池中,通入燃料的电极为负极,发生氧化反应。根据装置图可知左侧是电子流出的一极,所以通入a气体的电极是原电池的负极。由于存在质子交换膜,所以甲醇被氧化生成二氧化碳,电极方程式为CH3OH-6e-+H2O=CO2↑+6H+;(5)电解氯化钠溶液的化学方程式为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,可知关系式1 mol CH4~8 mol e﹣~8molNaOH,故若每个电池甲烷通入量为0.224L(标准状况),生成0.08molNaOH,c(NaOH)=0.08mol÷0.8L=0.1mol/L,pH=13;电解池通过的电量为
2NaOH+H2↑+Cl2↑,可知关系式1 mol CH4~8 mol e﹣~8molNaOH,故若每个电池甲烷通入量为0.224L(标准状况),生成0.08molNaOH,c(NaOH)=0.08mol÷0.8L=0.1mol/L,pH=13;电解池通过的电量为![]() ×8×9.65×104Cmol﹣1=7.72×103C(题中虽然有两个燃料电池,但电子的传递量只能用一个池的甲烷量计算。
×8×9.65×104Cmol﹣1=7.72×103C(题中虽然有两个燃料电池,但电子的传递量只能用一个池的甲烷量计算。


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
【题目】下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是( )
选项 | A | B | C | D |
强电解质 | Fe | NaCl | CaCO3 | HNO3 |
弱电解质 | CH3COOH | NH3 | H3PO4 | Fe(OH)3 |
非电解质 | 蔗糖 | BaSO4 | 酒精 | H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室下列物质的保存方法中,不正确的是( )
A. 氯化亚铁溶液存放在加有少量铁粉的试剂瓶中
B. 氢氧化钠溶液盛装在广口试剂瓶中
C. 过氧化钠要密封保存
D. 铝片放在不密封的容器里
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中能大量共存的是( )
A.Na+、Al3+、Cl-、SO42- B.Cu2+、Cl-、NO3-、OH-,
C.Ca2+、Na+、CO32-、NO3- D.H+、SO42-、NO3-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 石油分馏、煤干馏均可得到烃
B. 乙烯制聚乙烯、苯制硝基苯均发生加聚反应
C. 蛋白质盐析、糖类水解均为化学变化
D. 乙醇制乙醛、乙酸制乙酸乙酯均为取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其制取如下:
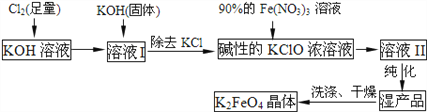
己知:①2KOH +Cl2→KCl+KClO+H2O(条件:温度较低)
②6KOH+3Cl2→5KCl+KClO3+3H2O (条件:温度较高)
③2Fe(NO3)3+2KClO3+10KOH→2K2FeO4+6KNO3+3KCl+5H2O
回答下列问题:(每空2分)
(1)高铁酸钾(K2FeO4)应在_______ (填“温度较高”或“温度较低”)情况下进行;
(2)0.1 mol/LKClO 溶液中 c (ClO-) +c (HClO)_______0.1 mol/L (填>、<、=)
(3)K2FeO4具有强氧化性的原因____________________________;
(4)配制KOH溶液时,是在每100 mL水中溶解56 gKOH固体(该溶液的密度为1.56g/mL),它的物质的量浓度为_________________;
(5)在“反应液Ⅰ”中加KOH固体的目的是_______________;
A.与“反应液I”中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物
D.使副产物KClO3转化为KClO
(6)从“反应液Ⅱ”中分离出K2FeO4后,会有副产品__________(写化学式),它们都是重要的化工产品,具体说出其中一种物质的用途_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com