
����Ŀ���������������Ļ��Գɷ֣�����Ԥ�����ಡ��Ҳ�ܻ��⼡��ؽ���ʹ�����������������Ľṹ��ͼ(RΪ����)������һ���������������J�ĺϳ�·�����£�


��֪��
��A��B��EΪͬϵ�����B����Է�������Ϊ44��A��B�˴Ź���������ʾ��������壻
�ڻ�����J�ķ���ʽΪC15H22O4��
��R1CHO+R2CH2CHO![]()
![]() +H2O
+H2O
�ش��������⣺
(1)G���������ŵ�����Ϊ_____________________��
(2)��A��B����C�Ļ�ѧ����ʽΪ_______________________________________��
(3)��C����D�ķ�Ӧ����Ϊ_____________��D�Ļ�ѧ����Ϊ_____________________��
(4)��H����I�Ļ�ѧ����ʽΪ_____________________��
(5)J�Ľṹ��ʽΪ_____________________��
(6)G��ͬ���칹���У������ϵ�һ�ȴ���ֻ��һ�ֵĹ���____��(���������칹)���˴Ź���������ʾ2������_____________________��(д�ṹ��ʽ)��
���𰸡��Ѽ��ͣ��ӣ��ǻ� ��CH3��3CCHO+CH3CHO![]() ��CH3��3CCH=CHCHO+H2O �ӳɣ���ԭ����Ӧ 4��4-����-1-�촼
��CH3��3CCH=CHCHO+H2O �ӳɣ���ԭ����Ӧ 4��4-����-1-�촼 ![]()
![]() 8
8 
��������
�����ת����ϵ��֪��D�����õ�E��E�����õ�F����D�д���-CH2OH�ṹ��E����-CHO��F����-COOH��F��I��Ӧ�õ�J��J�ķ���ʽΪC15H22O4�����J�Ľṹ�ص㣬��֪FΪC6H13COOH��A��B��EΪͬϵ�B����Է�������Ϊ44��A��B�˴Ź���������ʾ��������壬��A�Ľṹ��ʽΪ��CH3��3CCHO��BΪCH3CHO����CΪ��CH3��3CCH=CHCHO��DΪ��CH3��3CCH2CH2CH2OH��EΪ��CH3��3CCH2CH2CHO��FΪ��CH3��3CCH2CH2COOH��G���������շ�������������ȡ����Ӧ����H��H������������Һ�з���ˮ�ⷴӦ I����֪IΪ![]() ��GΪ
��GΪ![]() ��HΪ
��HΪ![]() ��JΪ
��JΪ![]() ��
��
��1��G�Ľṹ��ʽΪ![]() ��������Ϊ�Ѽ��ͣ��ӣ��ǻ����ʴ�Ϊ���Ѽ��ͣ��ӣ��ǻ���
��������Ϊ�Ѽ��ͣ��ӣ��ǻ����ʴ�Ϊ���Ѽ��ͣ��ӣ��ǻ���
(2)��A��B����C�ķ�ӦΪ��CH3��3CCHO��CH3CHO������Ϣ�۷�Ӧ���ɣ�CH3��3CCH=CHCHO����Ӧ�Ļ�ѧ����ʽΪ��CH3��3CCHO+CH3CHO![]() ��CH3��3CCH=CHCHO+H2O���ʴ�Ϊ����CH3��3CCHO+CH3CHO
��CH3��3CCH=CHCHO+H2O���ʴ�Ϊ����CH3��3CCHO+CH3CHO![]() ��CH3��3CCH=CHCHO+H2O��
��CH3��3CCH=CHCHO+H2O��
(3)��C����D�ķ�ӦΪ��CH3��3CCH=CHCHOһ�������������������ӳɷ�Ӧ���ɣ�CH3��3CCH2CH2CH2OH��D�Ľṹ��ʽΪ��CH3��3CCH2CH2CH2OH��ϵͳ����������Ϊ4��4-����-1-�촼���ʴ�Ϊ���ӳɣ���ԭ����Ӧ��4��4-����-1-�촼��
(4)��H����I�ķ�ӦΪ![]() ���������Ʒ�Ӧ����
���������Ʒ�Ӧ����![]() ����Ӧ�Ļ�ѧ����ʽΪ
����Ӧ�Ļ�ѧ����ʽΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
(5)��CH3��3CCH2CH2COOH ��![]() ��Ũ���������¼��뷴Ӧ����J����J�Ľṹ��ʽΪ
��Ũ���������¼��뷴Ӧ����J����J�Ľṹ��ʽΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��6��GΪ![]() ����ͬ���칹���У������ϵ�һ�ȴ���ֻ��һ�֣����Ժ���2��-CH2OH�Ҵ��ڶ�λ������2��-OCH3�Ҵ��ڶ�λ�����Ժ���4��ȡ������Ϊ2��-OH��2��-CH3����2��������ʱ������2��-OH�ֱ�������ڣ���ֱ�������ڼ�λ����2�������ڼ�λʱ������2��-OH���ڶ�λ�ҷֱ�������ڡ���䣬��2������λʱ��2��-OH�ֱ���2����������2���ǻ����ڶ�λ������2���ǻ����ڶ�λ������2��-OH����1�������ڣ��ʷ���������ͬ���칹����8�֣��˴Ź���������ʾ2������
����ͬ���칹���У������ϵ�һ�ȴ���ֻ��һ�֣����Ժ���2��-CH2OH�Ҵ��ڶ�λ������2��-OCH3�Ҵ��ڶ�λ�����Ժ���4��ȡ������Ϊ2��-OH��2��-CH3����2��������ʱ������2��-OH�ֱ�������ڣ���ֱ�������ڼ�λ����2�������ڼ�λʱ������2��-OH���ڶ�λ�ҷֱ�������ڡ���䣬��2������λʱ��2��-OH�ֱ���2����������2���ǻ����ڶ�λ������2���ǻ����ڶ�λ������2��-OH����1�������ڣ��ʷ���������ͬ���칹����8�֣��˴Ź���������ʾ2������ ���ʴ�Ϊ��8��
���ʴ�Ϊ��8�� ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������Ȳ��ʵ���У�����˵���������( )
A. ��Ӧ��ԭ��֮һCaC2���׳Ƶ�ʯ�����ɽ�̿����ʯ���ڵ�¯�и��·�Ӧ�Ƶ�
B. ��ʵ���п��ñ���ʳ��ˮ���洿ˮ�������ڿ��Ʒ�Ӧ����
C. �÷�Ӧԭ���ǣ�CaC2+2H2O��HC![]() CH
CH![]() +Ca(OH)2
+Ca(OH)2
D. ��Ӧ�����л��ŵ����ŵ���ζ����Ϊ��ʯ�к��е�������ɵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��д�����з���ʽ��
��1���������ĵ��뷽��ʽ��___��
��2��BaCO3��ϡ������Һ��Ӧ�Ļ�ѧ����ʽ��____��
��3��ʵ�����������Ļ�ѧ����ʽ��____��
��4��д����ҵ��Ư�۵Ļ�ѧ����ʽ��____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ�����
��1���Ҵ�ͬ���칹��Ľṹ��ʽ__________����������Ҫ�ɷֵĻ�ѧʽ__________��
��2��������ˮ��Ӧ�����ӷ���ʽ____________________________________________��
��3����������������Һ��Ӧ�Ļ�ѧ����ʽ____________________________________��
��4��̼�����Ƶĵ��뷽��ʽ________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������NOCl�����ںϳ������ȡ�������Cl2��NO�ڳ��³�ѹ�ºϳɣ������۵�Ϊ-64.5�棬�е�Ϊ-5.5�棬�������ǻ�ɫ���ж����壬��ˮ��ˮ�⡣ �밴Ҫ��ش�����������⣺
(1)������м��ϡ�����ַ�Ӧ�Ʊ�NO�����ӷ���ʽΪ��______________________��
(2)�Ʊ�NOCl��װ������ͼ��ʾ������˳��Ϊ:a��_________________________(�������������ҷ�����Сд��ĸ��ʾ)��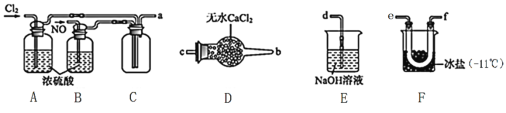
��װ��A��B�����Ǣٸ���NO��Cl2����___________________________________________��
��װ��D��������______________________________________��
��װ��E��NOCl������Ӧ�Ļ�ѧ����ʽΪ________________��
(3)��ҵ����������NOβ�����������ж��֣����м�ӵ绯ѧ������ԭ����ͼ��ʾ��

�ù����������ĵ缫��ӦʽΪ��__________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��ȷ���� ( )
A. ��ʯī���缫��� AlC13 ��Һ��2Cl- +2H2O![]() Cl2��+H2��+2OH
Cl2��+H2��+2OH
B. ���Ը��������Һ�� H2O2 ��Һ��ϣ�2MnO4 + 3H2O2 + 6H+= 2Mn2++ 4O2��+6H2O
C. �������������Һ�еμ�ϡ���3S2O32-+2H+=2SO42-+4S��+H2O
D. �� Mg(HCO3)2 ��Һ�м������� Ca(OH)2 ����Һ��Mg2++2HCO3- +4OH- +2Ca2+=3H2O+2CaCO3��+ Mg(OH)2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ��Ӧ 2Mg+CO2 ![]() 2MgO+C��H��0 ���ر�Ƕȿ������Է�����
2MgO+C��H��0 ���ر�Ƕȿ������Է�����
B. ���ܱ������������淴Ӧ��2NO(g)+2CO(g)N2(g)+2CO2(g)��H=��113.0kJ/mol���ﵽƽ������¶Ȳ�������С������������´ﵽƽ�������H ��С
C. ���� HClO �� Ka=3.0��108��H2CO3 �� Ka1=4.3��107��Ka2=5.6��1011�����Ʋ���ͬ״�� �£���Ũ�ȵ� NaClO �� Na2CO3 ��Һ�У�pH ǰ��С�ں���
D. ��֪��Ksp(AgCl)=1.8��1010��Ksp(Ag2CrO4)=2.0��1012���������Ũ��Ϊ1.0��10��4mol/L �� AgNO3 ��Һ���뵽Ũ�Ⱦ�Ϊ 1.0��10��4mol/L �� KCl �� K2CrO4 �Ļ����Һ�в������ֲ�ͬ�������� Ag2CrO4 �����Ȳ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH3 ��Ϊһ����Ҫ����ԭ����������Ӧ���ڹ�ҵ�����������й����ʷ�Ӧ�� �����о������������ 863 �ƻ���
(1)���������н�ǿ��ѡ��������רһ������֪����Ӧ I ��4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g)��H= 905.0 kJ��mol-1 ��Ӧ II : 4NH3(g)+3O2(g)
4NO(g) +6H2O(g)��H= 905.0 kJ��mol-1 ��Ӧ II : 4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) ��H= 1266.6 kJ��mol-1 д�� NO �ֽ����� N2 �� O2 ���Ȼ�ѧ����ʽ_________��
2N2(g) +6H2O(g) ��H= 1266.6 kJ��mol-1 д�� NO �ֽ����� N2 �� O2 ���Ȼ�ѧ����ʽ_________��
(2)�ں��º���װ���г���һ������ NH3 �� O2,��ij�����������½��з�Ӧ I ,��ò�ͬʱ ��� NH3 �� O2,��Ũ�����±���
ʱ��(min) | 0 | 5 | 10 | 15 | 20 | 25 |
c(NH3)/mol��L1 | 1.00 | 0.36 | 0.12 | 0.08 | 0.072 | 0.072 |
c(O2)/mol L1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
�������й���������ȷ����_____��
A��ʹ�ô���ʱ���ɽ��÷�Ӧ�Ļ�����ӿ��䷴Ӧ����
B������������� 4v ��(NH3) =6v ��(H2O)ʱ��˵����Ӧ�Ѵ�ƽ��
C����������n(NO)/n(NH3)=1 ʱ��˵����Ӧ�Ѵ�ƽ��
D��ǰ 10 �����ڵ�ƽ������ v( NO)=0.088 mol��L-1��min-1
(3)�Ʊ�����ʱ������һ���ķ�Һ����ҵ�ϳ�������������ͳ�ȥ��Һ�е� Cu2+�� ��֪��25��ʱ��K1(H2S) =1.3��107��K2(H2S) =7.1��1015��Ksp(CuS) =8.5��1045
���ڼ�����Һ�е�����Ũ��ʱ���漰����ĵ���ͨ��Ҫ���н��ƴ������� 0.lmol L1 ���� ��� pH��______(ȡ��������)��
��ijͬѧͨ�����Ƽ��㷢�� 0.lmol L1 �������� 0.0lmol L1 �������е� c(S2)��������� ����_____mol��L1
����֪��ij��Һ�ӽ������ԣ������������������ᣬ����Һ�� c(Cu2+) >_____mol��L1(���� ���������λ��Ч����)���ͻ���� CuS ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������⣩NH4Al(SO4)2��12H2O(�����)��������ĭ���������������ʯ����ɫ���ȡ�ij��ȤС��ͬѧ�������������ۡ�þ��������ص����������ȷ�Ӧ������Ҽ�����淋�Ϊԭ���Ʊ��������ʵ�飬�������£�
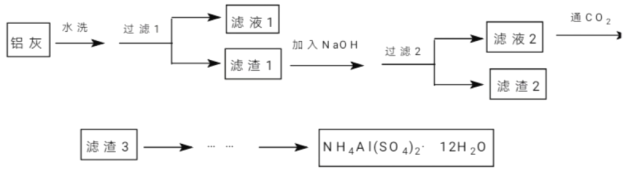
(1)�����й�˵������ȷ����_________��
A������Һ1���к���K+��Mg2+��Cl-
B��������1����������2���к�����ͬ������
C��������1��������������������ʵ��ʱ��
D��������Һ3�����ɲ����գ��ɵô���
(2)��NaOH�ܽ�������1��ʱ�����Բ���_________�ķ�ʽ��߽�����(д��3��)��
(3)������Һ2����ͨ��������CO2��д����Ӧ�����ӷ�Ӧ����ʽ__________________��
(4)��������3���Ʊ���������������²��裺a��g��_________��h(����������ȷ�����)
a���������ܽ� b������
c��������������
d�����½ᾧ
e��������������־�Ĥ
f�����Ʊ����������Һ
g������������Һת����������
h��ϴ�ӡ�����
(5)�ٸ��ݸ����ʵ��ܽ������(����ͼ)����80��ʱ����һ��Ũ�ȵ������ܽ�������3��ʱ�������˵�����Ũ��Ϊ_________��

A��3mol/L(1.20g/mL)
B��6mol/L(1.34g/mL)
C��9mol/L(1.49 g/mL)
D��18mol/L (1.84g/mL)
���������������ļ��ȷ��������__________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com