
 .与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为KOH+HBrO4=KBrO4+H2O.
.与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为KOH+HBrO4=KBrO4+H2O.分析 (1)铝的原子序数是13,核外13个电子.有三个电子层,最外层有3个电子,其最高价氧化物对应水化物是氢氧化铝,溶液中存在碱式电离和酸式电离;
(2)铁是26号元素,原子核外有四个电子层,最外层2个电子;与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物为KOH,酸性最强的化合物为HBrO4,酸碱中和反应生成盐和水;
(3)在FeC13稀溶液中滴加KSCN溶液后呈红色是铁离子的特征性质,铁离子和硫氰根离子形成络合物的反应是可逆反应;
(4)若先往FeCl3溶液中加入足量NaF溶液,再滴加KSCN溶液,则不呈红色说明铁离子和氟离子发生反应生成络离子,加入足量FeCl3溶液,溶液又呈血红色,说明SCN-加入的过量.
解答 解:(1)铝的原子序数是13,核外13个电子.有三个电子层,最外层有3个电子,位于周期表中第三周期第ⅢA族,铝的最高价氧化物对应水化物为Al(OH)3,氢氧化铝是两性氢氧化物,溶液中存在酸式电离和碱式电离,电离方程式为:H++AlO2-+H2O?Al(OH)3?Al3++3OH-,
故答案为:第三周期第ⅢA族;H++AlO2-+H2O?Al(OH)3?Al3++3OH-;
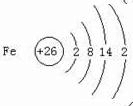
(2)铁是26号元素,原子核外有四个电子层,最外层2个电子,原子结构示意图为: ,与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物为KOH,酸性最强的化合物为HBrO4,酸碱都是一元酸碱,中和反应生成盐和水,反应的化学方程式为:KOH+HBrO4=KBrO4+H2O,
,与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物为KOH,酸性最强的化合物为HBrO4,酸碱都是一元酸碱,中和反应生成盐和水,反应的化学方程式为:KOH+HBrO4=KBrO4+H2O,
故答案为: ;KOH+HBrO4=KBrO4+H2O;
;KOH+HBrO4=KBrO4+H2O;
(3)铁离子和硫氰酸根离子反应生成血红色溶液,形成平衡的离子方程式为:Fe3++3SCN-=Fe(SCN)3,若在其中加入少量KCl固体,溶解后形成的氯离子和钾离子对平衡无影响,平衡状态和氯化钾的离子浓度无关,所以平衡不动,溶液颜色不变,
故答案为:Fe3++3SCN-=Fe(SCN)3;不变;
(4)若先往FeCl3溶液中加入足量NaF溶液,再滴加KSCN溶液,则不呈红色,证明铁离子和氟离子发生反应生成更为稳定的无色FeF63-络离子,若再加入足够量FeCl3溶液.又会呈现红色,说明SCN-没有被消耗,
故答案为:Fe3+更易与F-结合,生成更为稳定的无色FeF63-,所以再滴加KSCN时,溶液不呈红色,再滴加足量FeCl3时,Fe3+又与SCN-结合,生成Fe(SCN)3,所以又呈现红色.
点评 本题考查了化学平衡影响因素、原子结构的分析,主要是平衡移动原理的分析判断,注意:Fe3++3SCN-=Fe(SCN)3,影响平衡的离子分析判断,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 北京市医疗机构临床检验结果报告单 | ||||
| 分析项目 | 检测结果 | 单位 | 参考范围 | |
| 1 | 锌(Zn) | 115.92 | μmol/L | 66-120 |
| 2 | 铁(Fe) | 6.95↓ | mmol/L | 7.52-11.82 |
| 3 | 钙(Ca) | 1.68 | mmol/L | 1.55-2.10 |
| … | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HOCH2COOCH2CH3 | B. | HOCH2CH2CH2COOH | C. | CH3CH(OH)CH2COOH | D. | CH3CH2CH(OH)COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 低温高压 | B. | 高温低压 | C. | 低温低压 | D. | 高温高压 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每摩尔H2O2分子含2NA个氧原子 | |
| B. | 标准状况下,22.4L水中含有NA个水分子 | |
| C. | 16g甲烷分子中含4NA个氢原子 | |
| D. | 100mL 1mol/L Na2SO4溶液含有0.2NA个Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合价升降总数不等 | B. | 这两个反应的类型不相同 | ||
| C. | 产物种类相同 | D. | 硫元素价态变化相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl得电子能力相同 | |
| B. | S2?、Cl?、K+、Ca2+半径逐渐增大 | |
| C. | 核外电子排布相同的微粒化学性质也相同 | |
| D. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com