
【题目】某0.2L无土栽培用的营养液中含有KCl、K2SO4、NH4Cl三种溶质,测得该营养液中部分离子的浓度柱状图如图甲所示:

(1)该营养液中K2SO4的物质的量浓度为____mol·L-1,含KCl的质量为____。
(2)该营养液中NH4Cl的物质的量为____。
(3)将该营养液加水稀释,稀释过程中NH![]() 的浓度(c)随溶液体积(V)变化的曲线如图乙所示,则V1=____,V2=___。
的浓度(c)随溶液体积(V)变化的曲线如图乙所示,则V1=____,V2=___。
【答案】4.0 14.9g 1.6mol 0.2 1.0
【解析】
(1)根据硫酸根离子的浓度可知硫酸钾的物质的量浓度,根据钾离子守恒可以计算出氯化钾的浓度及质量;
(2)根据氯离子的总浓度、氯化钾的浓度可以计算出氯化铵的物质的量浓度,再根据n=cV计算出氯化铵的物质的量;
(3)据c=n/V可知V=n/c,代入数据求算即可。
(1)硫酸根离子物质的量浓度为4.0mol·L-1,则硫酸钾的物质的量浓度为:c(K2SO4)=c(SO42-)=4.0mol·L-1;根据钾离子守恒可知,c(K+)=c(KCl)+2c(K2SO4),则c(KCl)=c(K+)-2c(K2SO4)=9.0mol·L-1-4.0mol·L-1×2=1.0mol·L-1,溶质氯化钾的质量为:m(KCl)=McV=74.5g·mol-1×1.0mol·L-1×0.2L=14.9 g;
(2)根据氯原子守恒可知,c(Cl-)=c(KCl)+c(NH4Cl),则:c(NH4Cl)=c(Cl-)-c(KCl)=9.0mol·L-1-1.0mol·L-1=8.0mol·L-1,氯化铵的物质的量为:n(NH4Cl)=8.0mol·L-1×0.2L=1.6mol;
(3)据c=n/V可知V=n/c,V1=1.6mol/8mol·L-1=0.2L,V2=1.6mol/1.6mol·L-1=1.0L;


科目:高中化学 来源: 题型:
【题目】(I)如图是几种烷烃的球棍模型:

(1)A、B、E三种烷烃的关系为___________,C、D、E的关系为__________。
(2)D的名称是__________(习惯命名法)。
(3)E的一氯代物有_______种,请写出一氯代物的结构简式:________________。
(II)甲烷、乙烯、苯三种有机物中具有下列性质的是
(1)在催化剂作用下能与纯溴反应,不能使酸性高锰酸钾溶液褪色的是________。
(2)见光能跟氯气发生取代反应,不能使酸性高锰酸钾溶液褪色的是________。
(3)在催化剂作用下加氢生成乙烷,加水生成酒精的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四期某些过渡元素在工业生产中有着极其重要的作用。
(1)铬是最硬的金属单质,被称为“不锈钢的添加剂”。
写出Cr在周期表中的位置___________;其原子核外电子排布的最高能层符号___________.
(2)在1 mol CrO5(其中Cr为+6价)中,含有过氧键的数目为___________。
(3)钒(23V)是我国的丰产元素,被称之为“工业的味精”,广泛用于催化及钢铁工业。回答下列问题:
写出钒原子价电子排布图___________;V2O5常用作SO2转化为SO3的催化剂。SO3的三聚体环状结构如图所示,该结构中S原子的杂化轨道类型为___________;

(4)Ni是一种优良的有机反应催化剂,Ni能与CO形成正四面体形的配合物Ni(CO)4,其中配原子是___________。
(5)钛称之为21世纪金属,具有一定的生物功能。钙钛矿(CaTiO3)晶体是工业获取钛的重要原料。 CaTiO3晶胞如下图,边长为a=0.266m,晶胞中Ti、Ca、O分别处于顶角、体心、面心位置。Ti与O间的最短距离为___________nm,与Ti紧邻的O个数为___________。

(6)在CaTiO3晶胞结构的另一种表示中,Ca处于各顶角位置,则T处于___________位置,O处于___________位置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的排放会带来全球“温室”效应,因此,引起国际关注和研究,渴望21世纪 CO2将作为新碳源被广泛使用。
(1)以 CO2 和 H2 为原料可得到 CH4 燃料。
已知:① CH4 (g) + CO2(g) = 2CO(g) + 2H2(g) △ H1= + 247kJ·mol-1
② CH4 (g) + H2O(g) = CO(g) + 3H2(g) △ H2= + 205kJ·mol-1
写出由 CO2 获得CH4的热化学方程式:_____。
(2)CO2与CH4经催化重整可制得合成气:CH4(g)+CO2(g) = CO(g)+2H2(g) 按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率影响如图所示。此反应优选温度为900℃的原因是______________________。


(3)以二氧化钛表面覆盖的Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
① 催化剂的催化效率与乙酸的生成速率随温度的变化关系如上图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是__________________。
② 为了提高该反应中CH4的转化率,可以采取的措施是________(写出两种) 。
③ 将Cu2Al2O4溶解在稀硝酸中离子方程式是________________________。

(4)O2辅助的Al—CO2电池工作原理如上图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。电池的负极反应式:_______________________。电池的正极反应式:2CO2+2e= C2O42该过程中,O2起催化作用,催化过程可表示为:i: 6 O2 + 6e = 6 O2 ii: ……写出ii的离子方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子,下列说法正确的是 ( )
A. X元素原子基态时的电子排布式为[Ar]4s24p3
B. X元素是第四周期第ⅤA族元素
C. Y元素原子的电子排布图为
D. Z元素具有两性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.8 g CO和0.2 g H2在足量的氧气中充分燃烧,使生成的CO2和水蒸气通过过量的过氧化钠,完全反应后固体的质量变化量是( )
A. 增加了3.0 gB. 减少了3.0 gC. 增加了2.6 gD. 减少了2.6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电池的简易装置图如下所示,a、b、y、x电极材料均为惰性电极,分别从A、B处通入乙醇和O2,用该装置进行实验,下列说法正确的是( )

A. a电极反应式为C2H5OH+12OH――12e-=2CO2↑+9H2O
B. AlCl3溶液中的总反应为2Cl-+2H2O=Cl2↑+H2↑+2OH-
C. 反应开始后,观察到x电极附近出现白色沉淀
D. 左侧电池每通入32gO2,右侧电解池共生成2mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某市售“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:

(1)该“84消毒液”中NaClO的物质的量浓度约为__mol/L。(保留1位小数)
(2)该同学参阅此“84消毒液”的配方,欲用NaClO固体配制480mL与市售物质的量浓度相同的“84消毒液”,下列说法正确的是___(填序号)。
A.如图所示的仪器中有三种是不需要的
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒会导致结果偏低
D.需要称量NaClO固体的质量为143.0g

(3)“84消毒液”与稀硫酸混合使用可增强其消毒能力,某消毒小组人员用98%(密度为1.84g/cm3)的浓硫酸配制500mL2.3mol/L的稀硫酸用于增强“84消毒液”的消毒能力。
①需用浓硫酸的体积为___mL。
②取用任意体积的浓硫酸时,下列物理量中不随所取体积的多少而变化的是____。
A.溶液中H2SO4的物质的量 B.溶液的浓度 C.溶液的质量 D.溶液的密度
③配制该稀硫酸过程中,下列情况会使所配制的溶液的浓度大于2.3mol/L的有___。
A.未经冷却趁热将溶液注入容量瓶中并进行定容
B.摇匀后发现液面低于刻度线,再加水至刻度线
C.容量瓶中原有少量蒸馏水
D.定容时俯视容量瓶刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是化学研究的基础,下图关于各实验装置(夹持装置已略去)的叙述,正确的是( )
A.  吸收HCl气体,并防止倒吸
吸收HCl气体,并防止倒吸
B. ![]() 准确量取一定体积K2Cr2O7标准溶液
准确量取一定体积K2Cr2O7标准溶液
C.  制备碳酸氢钠
制备碳酸氢钠
D. 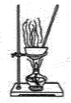 蒸干FeCl3溶液制备无水FeC13
蒸干FeCl3溶液制备无水FeC13
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com