
| A、NH4+、H+、I-、CrO42- |
| B、Pb2+、Na+、Cl-、SO42- |
| C、Na+、Mg2+、Cl-、SO42- |
| D、Na+、Al3+、Br-、CO32- |


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
| 酸 | HX | HY | HZ | ||
| 浓度(mol/L) | 0.12 | 0.2 | 0.9 | 1 | 1 |
| 电离度 | 0.25 | 0.2 | 0.1 | 0.3 | 0.5 |
| 电离常数 | K1 | K2 | K3 | K4 | K5 |
| A、在相同温度,从HX的数据可以说明:弱电解质溶液,浓度越低,电离度越大,且K1>K2>K3=0.01 | ||
B、室温时,若在NaZ溶液中加水,则
| ||
| C、等物质的量的 NaX、NaY和NaZ的三种溶液,其pH:NaX<NaY<NaZ | ||
| D、在相同温度下,K5>K4>K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素X在周期表中的位置为第2周期VIA族 |
| B、元素X、Y、Z的原子半径由大到小的顺序为r(Z)>r(Y)>r(X) |
| C、1mol甲与足量的乙完全反应转移的电子数为6.02×1023 |
| D、1.0L 0.1mol?L-1戊溶液中阴离子的总物质的量小于0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2、O3 |
| B、H2SO4、H2CO3 |
| C、SO2、NO |
| D、Na2SO3、KClO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、固体A主要是SiO2 |
| B、固体X主要是Fe(OH)3和Mg (OH)2 |
| C、滤液D中通入过量CO2发生的主要反应为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3 |
| D、滤液E中含有NaHCO3,NaHCO3是焙制糕点所用的发酵粉的主要成分之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:
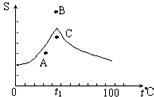 Na2SO4溶液的溶解度曲线如图,下列说法一定错误的是( )
Na2SO4溶液的溶解度曲线如图,下列说法一定错误的是( )| A、A点表示Na2SO4溶液尚未达到饱和,但降温和加入Na2SO4?H2O晶体都可使其饱和 |
| B、B、C点表示t1℃时,Na2SO4溶液在B点的溶解度大于在C点的溶解度 |
| C、在C点时Na2SO4溶液降温或升温,都会使其溶液变浑浊 |
| D、制取芒硝的最佳方法是在100℃时配成饱和溶液,再降温至0℃析出晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H2)?c(CO) |
| c(H2O) |
| n(CH4) |
| n(H2O) |

查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com