
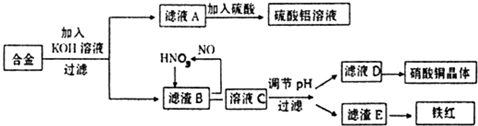


科目:高中化学 来源: 题型:
| A、饱和Ca(OH)2溶液中加入一定量的生石灰,恢复至原来的温度,得溶液的pH值会增大 |
| B、等体积、等pH的NH4Cl溶液和盐酸,完全溶解少量且等同的镁粉,前者反应快 |
| C、将nmol H2(g)、n mol I2(g)和2n mol H2(g)、2n mol I2(g)分别充入两个恒温恒容的容器中,平衡时H2的转化率前者小于后者 |
| D、某物质的溶液中由水电离出的c(H+)=1×10-amol.L-1,若α>7时,则该溶液的pH一定为14-α |
查看答案和解析>>
科目:高中化学 来源: 题型:
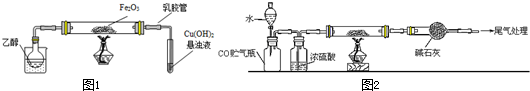
| x |
| y |
查看答案和解析>>
科目:高中化学 来源: 题型:
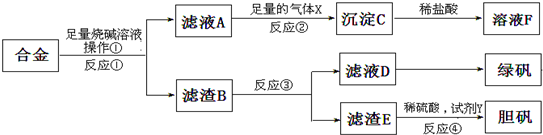
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、W、M的某种单质可作为水处理中的消毒剂 |
| B、电解YW2的熔融物可制得Y和W的单质 |
| C、相同条件下,W的氢化物水溶液酸性比Z弱 |
| D、X、M两种元素形成的一种化合物与水反应可生成M的某种单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
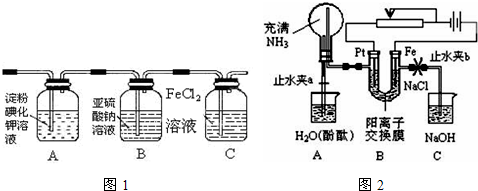
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量洗气瓶B中溶液于试管A中,滴加 | 若产生白色沉淀,则洗气瓶B溶液中存在SO42-. |
| 步骤2:另取适量洗气瓶B中溶液于试管B中,滴加 | 产生白色沉淀. |
| 步骤3:取步骤2后试管B中的上层清液于试管C中 滴加 |
查看答案和解析>>
科目:高中化学 来源: 题型:
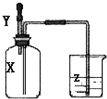 如图所示,集气瓶内充满某气体X,将滴管内的溶液Y挤入集气瓶后,烧杯中的溶液Z会进入集气瓶,然后又会有溶液被压回烧杯,则下列组合正确的是( )
如图所示,集气瓶内充满某气体X,将滴管内的溶液Y挤入集气瓶后,烧杯中的溶液Z会进入集气瓶,然后又会有溶液被压回烧杯,则下列组合正确的是( )| ① | X是甲烷,Y是高锰酸钾溶液,Z水 |
| ② | X是HCl,Y是浓硫酸,Z溴水 |
| ③ | X是氨气,Y是盐酸,Z浓氢氧化钠溶液 |
| ④ | X是SO2,Y是氢氧化钠溶液,Z浓硫酸 |
| A、①② | B、②④ | C、③④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
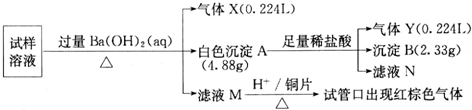
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com