
某化学兴趣小组对加碘食盐中碘酸钾进行研究。
(1)学生甲设计实验测出加碘食盐中碘元素的含量,步骤如下:
a.称取W g加碘盐,加适量蒸馏水溶解;
b.用稀硫酸酸化,再加入过量KI溶液;
c.以淀粉为指示剂,用物质的量浓度为1.00×10-3 mol·L-1的Na2S2O3标准溶液滴定。
(已知:IO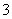 +5I-+6H+===3I2+3H2O,I2+2S2O
+5I-+6H+===3I2+3H2O,I2+2S2O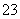 ===2I-+S4O
===2I-+S4O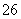 )
)
滴定时Na2S2O3溶液应放在________(填“酸式滴定管”或“碱式滴定管”),滴定至终点时消耗Na2S2O3溶液20.00 mL,其终点颜色变化为________;加碘食盐样品中的碘元素含量是____________mg·kg-1(以含W的代数式表示)。
(2)学生乙对纯净的NaCl(不含KIO3)进行了下列实验:
| 顺序 | 步骤 | 实验现象 |
| ① | 取少量纯净的NaCl, 加蒸馏水溶解 | 溶液无变化 |
| ② | 滴加淀粉KI溶液,振荡 | 溶液无变化 |
| ③ | 然后再滴加稀H2SO4溶液,振荡 | 溶液变蓝色 |
请推测实验③中产生蓝色现象的可能原因:__________;根据学生乙的实验结果,请对学生甲的实验结果作出简要评价____________________。
(3)工业上通常用电解KI溶液的方法来制备碘酸钾,电解过程中请你帮助学生丙设计实验来判断电解是否完全。仪器不限,可选的试剂:淀粉溶液、H2O2溶液、稀硫酸。
| 实验操作 | 实验现象及结论 |
科目:高中化学 来源: 题型:
已知元素X的电负性数值为2.5,元素Y的电负性数值是3.5,元素Z的电负性数值为1.2,元素W的电负性数值为2.4。你认为上述四种元素中,哪两种最容易形成离子化合物
A.X与Y B.X与W C.Y与Z D.Y与W
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关盐类水解的说法不正确的是( )
A.盐类水解过程破坏了纯水的电离平衡 B.盐类水解反应是酸碱中和反应的逆反应
C.盐类水解的结果使溶液不一定呈中性 D.Na2S溶液中c(Na+)是c(S2-)的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
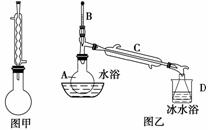
苯甲酸甲酯是一种重要的香料。其合成装置为
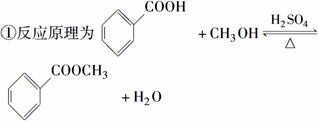
②反应物和产物的部分性质如下表所示:
| 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
| 苯甲酸 | 249 | 1.265 9 | 微溶于水 |
| 甲醇 | 64.6 | 0.791 0 | 易溶于水 |
| 苯甲酸甲酯 | 198 | 1.090 0 | 不溶于水 |
③实验步骤如下:
步骤一:在干燥的圆底烧瓶(如图甲)中加入12.20 g苯甲酸和12.10 mL甲醇。边缓缓摇动边加入3 mL浓硫酸,再加上几粒固体X,装上冷凝管,加热。
步骤二:取下图甲所示冷凝管,在烧瓶上安装图乙所示的装置,利用热水浴加热烧瓶;一段时间后,冷却,将烧瓶中溶液倒入分液漏斗中,先用水洗涤,再用浓碳酸钠溶液洗涤即得粗苯甲酸甲酯。
步骤三:将苯甲酸甲酯重新加入图乙所示装置中,加热,收集一定温度下的馏分,即得纯净的苯甲酸甲酯,质量为8.84 g。
回答下列问题:
(1)步骤一中固体X的作用是防止暴沸,X的名称是________________________。
(2)图甲装置中冷凝管的作用是________________________________________。
(3)图乙装置中仪器A的名称是________,仪器D的名称是________。
(4)步骤二中热水浴的目的是______________________,在分液漏斗中用水洗涤的目的是__________________,用碳酸钠洗涤的目的是______________________。
(5)步骤三中收集的馏分温度范围为________。(填正确答案标号)
a.63~66 ℃ b.197~198 ℃
c.248~250 ℃ d.>250 ℃
(6)本实验中,苯甲酸甲酯的产率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:

某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计表(表中不要留空格):
| 编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
| ① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
| ② | 醋酸浓度的影响 | 0.5 | 36.0 | |
| ③ | 0.2 | 2.0 | 90.0 |
(2)编号①实验测得容器中压强随时间变化如图2。t2时,容器中压强明显小于起始压强,其原因是铁发生了________腐蚀,请在图3中用箭头标出发生该腐蚀时电子流动方向;此时,碳粉表面发生了________(填“氧化”或“还原”)反应,其电极反应式是______________________________。

(3)该小组对图2中0~t1时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二:________________________________________________________________________;
……
(4)为验证假设一,某同学设计了检验收集的气体中是否含有H2的方案。请你再设计一个实验方案验证假设一,写出实验步骤和结论。
| 实验步骤和结论(不要求写具体操作过程): |
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g) 4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为5∶4(相同的温度下测量),则下列说法正确的是( )
4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为5∶4(相同的温度下测量),则下列说法正确的是( )
A.该反应的化学平衡常数表达式是
B.此时,B的平衡转化率是35%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.增加C,B的平衡转化率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
有关物质存在如图所示的转化关系(部分产物已省略)。通常C为气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。
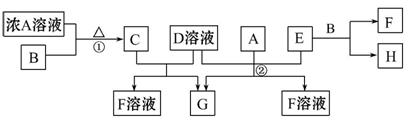
请回答下列问题:
(1)F的电子式为 。
(2)反应①的化学方程式为 。
(3)反应②的离子方程式为 。
(4)写出另外一种实验室制取H的化学方程式 。
(5)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Ksp=7.0×10-9。将等体积的D溶液与Pb(NO3)2溶液混合,若D的浓度为1.0×10-2mol·L-1,则生成沉淀所需Pb(NO3)2溶液的最小浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E五种短周期元素,原子序数依次增大。A元素的单质是自然界最轻的气体,E单质需保存在煤油中。A与B、C分别构成电子数相等的化合物M、N,且M是一种能产生温室效应的最简单的有机气体物质;D元素最外层电子数是次外层电子数的3倍;回答下列问题:
(1)M分子中含有 (填“极性”或“非极性”)键。
(2)D与E以1∶1形成的化合物与水反应的化学反应方程式 。
(3)A、B、C、D可形成阳离子和阴离子个数比是1∶1的离子化合物X;A、D、E可形成化合物Y;X与Y以物质的量之比1∶2加热反应,写出反应的化学方程式 ,反应生成的固体产物水溶液显碱性,原因是 (用离子方程式表示)。
(4)由N与D的单质、KOH溶液可以构成原电池,负极会产生C的单质,则其负极反应为 ;一段时间后,溶液pH (填“增大”“减小”或“不变”)。
(5)在一定温度下,将4 mol C单质和12 mol A单质通入到体积为2 L的密闭容器中,发生反应,2 min达到平衡状态时,A单质的转化率是50%,则用A单质表示该反应的平均速率为 。该温度下的平衡常数为K= 。(保留两位有效数字)
(6)从化学平衡移动的角度分析,提高A单质的转化率可以采取的措施是
(选填序号字母)。
a.及时分离出生成物 b.平衡后再加入6 mol A物质 c.增大压强 d.使用催化剂 e.平衡后再加入2 mol C物质
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)臭氧可用于净化空气、饮用水消毒、处理工业废物和作为漂白剂。
①臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O3(g)===3Ag2O(s) ΔH=-235.8 kJ·mol-1。
已知2Ag2O(s)===4Ag(s)+O2(g) ΔH=+62.2 kJ·mol-1,则O3转化为O2的热化学方程式为________________;
②科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产生,阴极附近的氧气则生成过氧化氢,阴极电极反应式为________________________
________________________________________________。
(2)用活性炭还原法处理氮氧化物,有关反应为C(s)+2NO(g)N2(g)+CO2(g)。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1 ℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
| 浓度/mol·L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
①10 min~20 min以v(CO2)表示的反应速率为______;
②根据表中数据,计算T1 ℃时该反应的平衡常数为______(保留两位小数);
③下列各项能作为判断该反应达到平衡标志的是______(填序号字母);
A.容器内压强保持不变
B.2v正(NO)=v逆(N2)
C.容器内CO2的体积分数不变
D.混合气体的密度保持不变
④30 min时改变某一条件,反应重新达到平衡,则改变的条件可能是________;
⑤一定温度下,随着NO的起始浓度增大,则NO的平衡转化率________(填“增大”、“不变”或“减小”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com