
【题目】用50mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1 NaOH溶液,在如图所示的装置中进行中和反应,测定强酸与强碱反应的反应热. 
起始温度t1/℃ | 终止温度t2/℃ | 温度差 | |||
HCl | NaOH | 平均值 | |||
1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
(1)在该实验中,量取50mL盐酸或NaOH溶液,需要用到的玻璃仪是;
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是;
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是指温度;
(4)计算该实验发生中和反应时放出的热量为kJ[中和后生成的溶液的比热容c=4.18J(g℃)﹣1 , 稀溶液的密度都为1gcm﹣3];
(5)如果用50mL 0.55mol/L的氨水(NH3H2O)代替NaOH溶液进行上述实验,通过测得的反应热计算中和热,其中和热△H会偏大,其原因是 .
【答案】
(1)量简和胶头滴管
(2)减少实验过程中的热量损失
(3)完全反应后混合溶液的最高
(4)1.34
(5)NH3?H2O是弱电解质,电离需要吸热(或生成的盐会水解,要吸收热量等)
【解析】解:(1)在该实验中,量取50mL盐酸或NaOH溶液,需要用到的玻璃仪是量筒和胶头滴管,所以答案是:量简和胶头滴管;(2)中和热测定实验中,必须尽量减少实验过程中热量的损失,所以答案是:减少实验过程中的热量损失;(3)氢氧化钠溶液与盐酸完全反应后混合溶液的最高温度为终止温度,所以答案是:完全反应后混合溶液的最高;(4)第三次得到温度差误差较大,应该舍弃,所以平均温度差为: ![]() =3.2℃,溶液的质量为:100ml×1g/ml=100g,则该反应中放出的热量为:Q=mc△T=100g×4.18J/(g℃)×3.2℃=1340J,即1.34kJ,所以答案是:1.34 kJ;(5)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量小于57.3kJ,所以答案是:NH3H2O是弱电解质,电离需要吸热(或生成的盐会水解,要吸收热量等).
=3.2℃,溶液的质量为:100ml×1g/ml=100g,则该反应中放出的热量为:Q=mc△T=100g×4.18J/(g℃)×3.2℃=1340J,即1.34kJ,所以答案是:1.34 kJ;(5)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量小于57.3kJ,所以答案是:NH3H2O是弱电解质,电离需要吸热(或生成的盐会水解,要吸收热量等).


科目:高中化学 来源: 题型:
【题目】在密闭容器中发生可逆反应4NH3(g)+5O2(g)4NO(g)+6H2O(g),以下是不同情况下的反应速率,其中最快的是( )
A.v(O2)=0.01 molL﹣1s﹣1
B.v(NH3)=0.02molL﹣1s﹣1
C.v(H2O)=0.06 molL﹣1min﹣1
D.v(NO)=0.03molL﹣1s﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4﹣(绿色)、Cr2O72﹣(橙红色)、CrO42﹣(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答:
(1)Cr3+与Al3+的化学性质相似,往Cr2(SO4)3溶液中滴入NaOH溶液直至过量,可观察到的现象是 .
(2)CrO42﹣和Cr2O72﹣在溶液中可相互转化.室温下,初始浓度为1.0molL﹣1的Na2CrO4溶液中c(Cr2O72﹣)随c(H+)的变化如图所示. 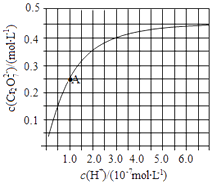
①用离子方程式表示Na2CrO4溶液中的转化反应 .
②由图可知,溶液酸性增强,CrO42﹣的平衡转化率(填“增大“减小”或“不变”).
根据A点数据,计算出该转化反应的平衡常数为 .
(3)用K2CrO4为指示剂,以AgNO3标准液滴定溶液中的Cl﹣ , Ag+与CrO42﹣生成砖红色沉淀时到达滴定终点.当溶液中Cl﹣恰好完全沉淀(浓度等于1.0×10﹣5molL﹣1)时,溶液中c (Ag+)为molL﹣1 , 此时溶液中c(CrO42﹣)等于molL﹣1 . (Ksp(Ag2CrO4)=2.0×10﹣12、Ksp(AgCl)=2.0×10﹣10).
(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72﹣还原成Cr3+ , 反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分子中既有σ键,又有π键的是( )
①HCl ②H2O ③N2 ④H2O2 ⑤C2H4 ⑥C2H2 .
A.①②③
B.③④⑤⑥
C.①③⑥
D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,氧化铁可以与一氧化碳发生下列反应:Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g)
(1)①该反应的平衡常数表达式为:K= .
②该温度下,在2L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g.则10min内CO的平均反应速为 .
(2)说明该反应已达到平衡状态: .
a.CO或(CO2)的生成速率与消耗速率相等;
b.CO(或CO2)的质量不再改变
c.CO(或CO2)的体积分数50%
(3)I2O5可使H2S、CO、HCl等氧化,常用于定量测定CO的含量.已知:
2I2(s)+5O2(g)=2I2O5(s)△H1=﹣75.56kJmol﹣1
2CO(g)+O2(g)=2CO2(g)△H2=﹣566.0kJmol﹣1
写出CO(g)与I2O5(s)反应生成I2(s)和CO2(g)的热化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1 NaOH溶液,在如图所示的装置中进行中和反应,测定强酸与强碱反应的反应热. 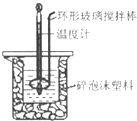
起始温度t1/℃ | 终止温度t2/℃ | 温度差 | |||
HCl | NaOH | 平均值 | |||
1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
(1)在该实验中,量取50mL盐酸或NaOH溶液,需要用到的玻璃仪是;
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是;
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是指温度;
(4)计算该实验发生中和反应时放出的热量为kJ[中和后生成的溶液的比热容c=4.18J(g℃)﹣1 , 稀溶液的密度都为1gcm﹣3];
(5)如果用50mL 0.55mol/L的氨水(NH3H2O)代替NaOH溶液进行上述实验,通过测得的反应热计算中和热,其中和热△H会偏大,其原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析城市空气样本,主要污染物为可吸入颗粒物pm2.5、NOx、SO2等,其主要来源为燃煤和机动车尾气排放等.
(1)某同学为检测样本中所含成份,将样本用蒸馏水处理制成待测试样,设计实验及实验现象如图:
①该实验能确认存在的阳离子是 .
②该实验检测出样本中有NO3﹣ , 根据是(用化学方程式解释) .
③根据该实验能否确定样本中含有SO32﹣ , (填“能”或“否”),若要确定SO32﹣ , 所需的实验药品可以是 .
(2)PM2.5是指大气中直径小于或等于2.5μm(1μm=103nm)的颗粒物.下列说法不正确的是(填字母序号).
a.PM2.5主要来源于火力发电、工业生产、汽车尾气排放等过程
b.PM2.5颗粒小,所以对人体无害
c.直径介于1~2.5μm的颗粒物分散到空气中可形成胶体
d.推广使用电动汽车,可以减少PM2.5的污染
(3)科研工作者用五年时间研究出利用石灰乳除工业燃煤尾气中的硫(SO2、SO3)和氮(NO、NO2)的新工艺,既能净化尾气,又能获得应用广泛的CaSO4和Ca(NO2)2 . 
①CaSO4可以调节水泥的硬化时间.尾气中SO2与石灰乳反应生成CaSO4的化学方程式为 .
②Ca(NO2)2可制成混凝土防冻剂、钢筋阻锈剂等.尾气中NO、NO2与石灰乳反应生成Ca(NO2)2的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A.1molCH4与4molCl2在光照下完全反应可生成1molCCl4
B.甲烷、苯、乙醇、乙酸和乙酸乙酯在一定条件下都能发生取代反应
C.乙烯能被酸性高锰酸钾溶液氧化,而苯不易
D.1体积的C2H4完全燃烧需同温同压下3体积的O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com