
【题目】已知某有机物的结构简式如图所示:下列有关说法正确的是( )
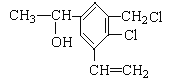
A.该有机物的化学式为C11H12OCl2
B.在同一平面上的碳原子数最多为10个
C.与NaOH醇溶液在加热条件下消去氯原子
D.在铜作催化剂和加热条件下能被O2氧化成醛
科目:高中化学 来源: 题型:
【题目】化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是
A.  Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B. 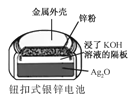 正极的电极反应式为Ag2O+2e+H2O2Ag+2OH
正极的电极反应式为Ag2O+2e+H2O2Ag+2OH
C.  锌筒作负极,发生氧化反应,锌筒会变薄
锌筒作负极,发生氧化反应,锌筒会变薄
D.  使用一段时间后,电解质溶液的酸性减弱,导电能力下降
使用一段时间后,电解质溶液的酸性减弱,导电能力下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各图的叙述错误的是![]()
化学方程式 | 平衡常数K |
|
|
|
|
|
|
|
|
A.已知1molCO燃烧放出的热为283kJ,![]() ;
;![]() 则
则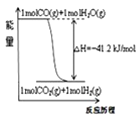 表示CO和
表示CO和![]() 生成
生成![]() 和
和![]() 的能量变化
的能量变化
B.常温下![]()
![]() HB溶液和
HB溶液和![]()
![]() 溶液等体积混合后溶液的
溶液等体积混合后溶液的![]() ,则混合溶液中离子浓度的大小顺序为:
,则混合溶液中离子浓度的大小顺序为:![]()
C.常温下,![]() 和
和![]() 反应生成HX的平衡常数如表所示,仅依据K的变化,就可以说明在相同条件下,平衡时
反应生成HX的平衡常数如表所示,仅依据K的变化,就可以说明在相同条件下,平衡时![]() 从
从![]() 到
到![]() 的转化率逐减小,且HX的还原性逐渐减弱
的转化率逐减小,且HX的还原性逐渐减弱
D.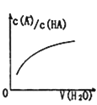 中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,
中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,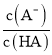 的变化情况
的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了A-F6种元素在周期表中短周期的位置。
C | D | ||||||
A | B | E | F |
请回答下列问题:
(1)C元素在周期表中的位置___;C元素的一种氧化物是温室气体,该氧化物的电子式为:___。
(2)A和B的最高价氧化物对应的水化物碱性较强的是___;(填化学式)
(3)D与同族下一周期元素的气态氢化物的沸点较高的是___(填化学式),原因是___。
(4)元素E与元素F相比,非金属性较强的是___(用元素符号填写),下列表述中能证明这一事实的是___(可多选)。
①F的氢化物比E的氢化物稳定
②常温下F的单质和E的单质状态不同
③一定条件下F和E的单质都能与氢氧化钠溶液反应
④F的氧化物的水化物的酸性比E的氧化物的水化物的酸性强
⑤F可以把E从其氢化物水溶液中置换出来
(5)元素E的一种氧化物通入氯化钡溶液无沉淀,通入硝酸钡溶液却会产生白色沉淀,写出少量该氧化物通入硝酸钡溶液的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4NH3(g) + 5O2(g) =4NO(g) + 6H2O(g),△H= —1025kJ/mol,该反应是一个可逆反应,若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是
A. 
B. 
C. 
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知CO2+3H2![]() CH3OH+H2O,在120℃时22gCO2发生上述反应,其反应过程的能量变化如图所示(单位为kJ·mol-1)。
CH3OH+H2O,在120℃时22gCO2发生上述反应,其反应过程的能量变化如图所示(单位为kJ·mol-1)。
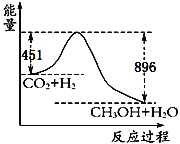
①该反应的热化学方程式为____________________。
②该反应平衡常数K的表达式为_______________________。
③在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2反应,测得CO2和CH3OH(g)的浓度随时间变化如图所示。从反应开始到达到化学平衡,v(H2)=______mol/(L·min),下列措施中能使![]() 增大的有__________(填字母)。
增大的有__________(填字母)。
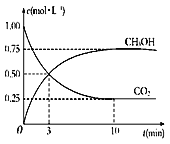
A.升高温度 B.加入催化剂 C.将H2O(g)从体系中分离
D.再充入3 mol H2 E.充入He(g),使体系总压强增大
(2)工业上常利用“隔膜电解法”处理高浓度乙醛废水。其原理是使乙醛分别在阴、阳极发生反应生成乙醇和乙酸,总反应式为2CH3CHO+H2O=CH3CH2OH+CH3COOH。实验室按右图所示装置来模拟乙醛废水的处理(以一定浓度的乙醛和Na2SO4溶液为电解质溶液)。
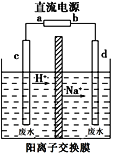
①若以甲醇碱性燃料电池为直流电源,则燃料电池中b极应通入____(填化学式)。
②电解池阳极区的电极反应式为_______________________________。
③在实际工艺处理中,阴极区乙醛的去除率可达60%。若在两极区分别注入乙醛含量为3g/L的废水1 m3,可得到乙醇________kg(计算结果保留小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是有机化学中的几个重要实验。图一是制取乙酸乙酯,图二是验证醋酸、碳酸、苯酚酸性强弱;图三是实验室制取乙炔并检验其部分性质。请根据要求填空。
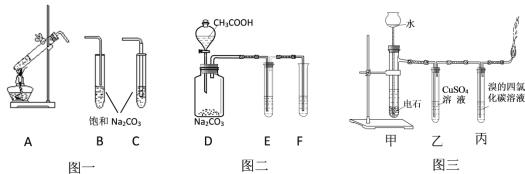
(1)图一中A发生的化学方程式为__________, A的导管应与_______相连(填字母)。
(2)图二中的E和F分别盛装的药品应为_____________和______________。
A.石蕊溶液 B.苯酚钠溶液 C.碳酸氢钠溶液 D.碳酸钠溶液
(3)图三中乙装置的作用是_______________,实验过程中发现燃烧非常剧烈,分析其主要原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,二元弱酸 H2Y 溶液中滴加 KOH 溶液,所得混合溶液的 pH 与离子浓度变化的关系如图所示,下列有关说法错误的是( )

A. 曲线 M 表示 pH与lg![]() 的变化关系
的变化关系
B. Ka2(H2Y)=10-4.3
C. d 点溶液中: c(H+)-c(OH -)=2c(Y2-)+ c(HY-)-c(K+)
D. 交点 e 的溶液中: c(H2Y) = c(Y2-) > c(HY-)> c(H+)> c(OH -)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物在我们的生产生活当中有着重要的作用,探究有机物结构有助于对物质的性质进行研究。
(1)a.![]() b.
b.![]() c.
c.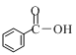
①上述三种物质中b,c中官能团名称分别是__________,__________。
②三种物质在一定条件分别与氢气发生加成反应,同温同压下消耗氢气量关系为______(填“相同”或“不相同”)。
(2)欲区分乙醛和乙酸,应选用 ____(填字母)。
a.NaOH溶液 b.HCl溶液 c.银氨溶液 d.新制氢氧化铜悬浊液
(3)工业上或实验室提纯以下物质的方法不合理的是(括号内为杂质)______。
A. 溴苯(溴):加NaOH溶液,分液 B. 乙烷(乙烯):通入溴水,洗气
C. 乙酸(水):加新制生石灰,蒸馏 D. 乙酸乙酯(乙酸):氢氧化钠溶液,分液
(4)苹果酸(![]() )与NaOH溶液反应的化学方程式___________。
)与NaOH溶液反应的化学方程式___________。
(5)以KOH为电解质的甲醇燃料电池总反应为2CH3OH+3O2+4KOH=2K2CO3+6H2O。电池放电时电解质溶液中OH-向_______(填“正”或“负”)极移动,负极反应式为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com