

 ③CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH④CH2=CH2+3O2$\stackrel{点燃}{→}$2CO2+2H2O.
③CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH④CH2=CH2+3O2$\stackrel{点燃}{→}$2CO2+2H2O. 分析 (1)(a)计算出氧元素的质量分数,然后计算出C、H、O元素的物质的量之比,从而得出其实验式;根据质谱图中数据判断该有机物的相对分子量;
(b)结合其实验式确定分子式,根据红外光谱图显示存在对称的甲基、对称的亚甲基和C-O-C结构,结合分子式确定其结构简式;
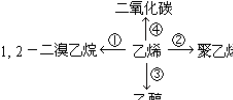
(2)①乙烯和溴能发生加成反应生成1,2-二溴乙烷;
②乙烯能发生加聚反应生成聚乙烯;
③一定条件下,乙烯能和水发生加成反应生成乙醇;
④乙烯能燃烧生成二氧化碳和水.
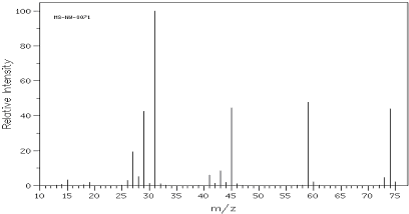
解答 解:(1)(a)碳的质量分数是64.86%,氢的质量分数是13.51%,氧元素质量分数是21.63%,则该物质中碳、氢、氧原子个数之比=$\frac{64.86%}{12}$:$\frac{13.51%}{1}$:$\frac{21.63%}{16}$=4:10:1,所以其实验式为:C4H10O,根据质谱图知,其相对分子质量是74,
故答案为:C4H10O;74;
(b)根据质谱图知,其相对分子质量是74,故其分子式为C4H10O,红外光谱图显示存在对称的甲基、对称的亚甲基和C-O-C结构,可得分子的结构简式为:CH3CH2OCH2CH3,
故答案为:CH3CH2OCH2CH3.
(2)①、乙烯和溴能发生加成反应生成1,2-二溴乙烷,反应方程式为:CH2=CH2+Br2→CH2BrCH2Br,
故答案为:CH2=CH2+Br2→CH2Br-CH2Br;
②、乙烯能发生加聚反应生成聚乙烯,反应方程式为:nCH2=CH2$\stackrel{一定条件}{→}$ ,
,
故答案为:nCH2=CH2$\stackrel{一定条件}{→}$ ;
;
③一定条件下,乙烯能和水发生加成反应生成乙醇,反应方程式为CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH,
故答案为:CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH;
④乙烯能燃烧生成二氧化碳和水,反应方程式为:CH2=CH2+3O2$\stackrel{点燃}{→}$2CO2+2H2O,
故答案为:CH2=CH2+3O2$\stackrel{点燃}{→}$2CO2+2H2O.
点评 本题考查了有机物分子式与结构的确定、乙烯的性质和制取,题目难度中等,能对质谱图、核磁共振氢谱、红外光谱进行简单的阅读、理解反应原理是解答的关键,注意有机方程的书写的符号和条件.


科目:高中化学 来源: 题型:选择题
| A. | 充入N2使压强增大可加快反应速率 | B. | A的平均反应速率为:0.4mol/(L•min) | ||
| C. | 平衡状态时B、C的反应速率相等 | D. | C的平均反应速率为:0.2mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4mol/L | B. | 0.2mol/L | C. | 0.1mol/L | D. | 0.08mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| 电解质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶度积(Ksp) | 2.2×10-20 | 8.0×10-16 | 4.0×10-38 |
| 开始沉淀时的pH | 5.4 | 6.5 | 3.5 |
| 完全沉淀时的pH | 6.4 | 9.6 | 4.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c (H2S) | |
| B. | Na2C2O4溶液:c (OH-)=c(H+)+c(HC2O4-)+2c (H2C2O4) | |
| C. | Na2CO3溶液:c (Na+)+c (H+)=2c (CO32-)+c (OH-) | |
| D. | CH3COONa和CaCl2混合溶液:c (Na+)+c (Ca2+)=c (CH3COO-)+c (CH3COOH)+2c (Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 不能氧化为氧化成醛或酸
不能氧化为氧化成醛或酸
 PMAA
PMAA
 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O;
+2H2O; $→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O.
$→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 氢氧化钡的体积/mL | 硫酸氢钠的体积/mL | 溶液的pH |
| ① | 33.00 | 0.00 | 8 |
| ② | 33.00 | x | 7 |
| ③ | 33.00 | 33.00 | 6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com