
| 1mol×70.74KJ |
| 0.25mol |
| 1mol×70.74KJ |
| 0.25mol |


科目:高中化学 来源: 题型:
A.CO(g)+ ![]() O 2(g)
O 2(g)![]() CO2(g)ΔH(288.5 K)=-282.97 kJ·mol-1
CO2(g)ΔH(288.5 K)=-282.97 kJ·mol-1
B.2CO(g)+O2(g) ![]() 2CO2 ΔH(288.5 K)=-565.6 kJ·mol-1
2CO2 ΔH(288.5 K)=-565.6 kJ·mol-1
C.CO(g)+![]() O 2(g)
O 2(g) ![]() CO2(g)ΔH(288.5 K)=70.7 kJ·mol-1
CO2(g)ΔH(288.5 K)=70.7 kJ·mol-1
D.CO(g)+![]() O 2(g)
O 2(g) ![]() CO2(g)ΔH(288.5 K)=+565.6 kJ·mol-1
CO2(g)ΔH(288.5 K)=+565.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
A.CO(g)+![]() O2(g)
O2(g)![]() CO2(g) ΔH(288.5 K)=-282.97 kJ· mol-1
CO2(g) ΔH(288.5 K)=-282.97 kJ· mol-1
B.2CO(g)+O2(g)![]() 2CO2 ΔH(288.5 K)=-565.6 kJ· mol-1
2CO2 ΔH(288.5 K)=-565.6 kJ· mol-1
C.CO(g)+![]() O2(g)
O2(g)![]() CO2(g) ΔH(288.5 K)=70.7 kJ· mol-1
CO2(g) ΔH(288.5 K)=70.7 kJ· mol-1
D.CO(g)+ ![]() O2(g)
O2(g)![]() CO2(g) ΔH(288.5 K)=+565.6 kJ· mol-1
CO2(g) ΔH(288.5 K)=+565.6 kJ· mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
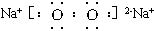
(1)A的化学式为____________________。
(2)N的电子式为____________________,所含化学键为____________________。
(3)A→C的离子方程式为________________________________。
(4)C→D的化学方程式为________________________________。
(5)已知标准状况下有
查看答案和解析>>
科目:高中化学 来源: 题型:
【12分】下列物质均为中学化学常见的物质,其转化关系如图所示,反应条件及部分产物未全部标出。已知A为正盐,试剂①和试剂②为中学化学实验室常用的试剂,其中B、C、D、E、G常温下为气体,H常温下为液体。
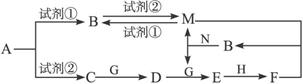
(1)A的化学式为____________________。
(2)N的电子式为____________________,所含化学键为____________________。
(3)A→C的离子方程式为________________________________。
(4)C→D的化学方程式为________________________________。
(5)已知标准状况下有33.6 L的C与G完全反应生成D,则转移的电子数为_______NA。
查看答案和解析>>
科目:高中化学 来源: 题型:
晶体硼由 ![]() 和
和![]() 两种同位素原子构成。已知5.4克晶体硼全部转化成B2H6(乙硼烷)气体时,可得标准状况下5.6升乙硼烷,则晶体硼中
两种同位素原子构成。已知5.4克晶体硼全部转化成B2H6(乙硼烷)气体时,可得标准状况下5.6升乙硼烷,则晶体硼中![]() 和
和![]() 两种同位素原子个数比为
两种同位素原子个数比为
A. 1:1 B. 1:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com