
【题目】高铁电池是一种新型可充电电池,高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
A. 放电时每转移3mol电子,正极有1molK2FeO4被氧化
B. 充电时阳极反应为:Fe(OH)3+5OH-3e-=FeO42-+4H2O
C. 放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
D. 放电时正极附近溶液的碱性增强
【答案】A
【解析】
根据电池总反应可知,放电时:锌的化合价升高,所以锌是负极,K2FeO4中铁元素化合价降低,所以K2FeO4为正极。
A项,由反应可知,转移6mol电子时正极有2mol K2FeO4被还原,则放电时每转移3mol电子,正极有1mol K2FeO4被还原,故A项错误;
B项,放电时,K2FeO4为正极,则充电时为阳极,发生氧化反应,方程式为Fe(OH)3-3e- + 5OH-= FeO42-+4H2O,故B项正确;
C项,放电时,Zn元素的化合价升高,Zn为负极,发生氧化反应,方程式为Zn-2e-+2OH- =Zn(OH)2,故C项正确;
D项,放电时正极反应为2FeO42-+8H2O+6e-=2 Fe(OH)3+10OH-,正极生成OH-,则正极附近溶液的碱性增强,故D项正确。
综上所述,本题选A。


科目:高中化学 来源: 题型:
【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室制备乙酸乙酯的化学方程式:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O,为证明浓硫酸在该反应中起到了催化剂和吸收剂的作用,某同学利用下图所示装置进行了以下四个实验,实验开始先用酒精灯微热3 min,再加热使之微微沸腾3min。实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
CH3COOC2H5+H2O,为证明浓硫酸在该反应中起到了催化剂和吸收剂的作用,某同学利用下图所示装置进行了以下四个实验,实验开始先用酒精灯微热3 min,再加热使之微微沸腾3min。实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
实验编号 | 试管Ⅰ中的试剂 | 试管Ⅱ中试剂 | 测得有机层的厚度/cm |
A | 2 mL乙醇、2 mL乙酸、1 mL 18 mol·L-1浓硫酸 | 饱和碳酸钠 溶液 | 5.0 |
B | 3 mL乙醇、2 mL乙酸 | 0.1 | |
C | 3 mL乙醇、2 mL乙酸、6mL 3 mol·L-1硫酸 | 1.2 | |
D | 3 mL乙醇、2 mL乙酸、盐酸 | 1.2 |
(1)实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是________mL和________mol/L。
(2)分析实验________(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。浓硫酸的吸水性能够提高乙酸乙酯产率的原因是_____________________。
(3)加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是______________(答出两条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于![]() (I)、
(I)、![]() (II)、
(II)、![]() (III)、
(III)、![]() (IV)化合物的说法正确的是
(IV)化合物的说法正确的是
A. Ⅰ、Ⅱ、Ⅲ、Ⅳ的沸点依次升高 B. Ⅰ、Ⅲ的一氯代物均只有四种
C. Ⅱ、Ⅲ中碳原子可能都处于同一平面 D. Ⅲ、Ⅳ都属于芳香族化合物,互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.充分燃烧2.8g某有机物A,生成8.8g CO2和3.6g H2O,这种有机物蒸气的相对密度是相同条件下N2的2倍。
(1)该有机物的分子式_______________,A的链状同分异构体共有__________种。
(2)A的链状同分异构体中含有支链的同分异构体的结构简式为_______________,其系统命名为__________________
(3)若该有机物跟HCl的加成产物只有一种,试确定其结构简式___________________
(4)若该有机物在核磁共振氢谱中只有一个信号峰(即只有一种氢原子),则用键线式表示的结构简式为___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用如图所示实验装置进行铁与水蒸气反应的实验,并对反应后硬质试管中固体物质的组成进行了探究。
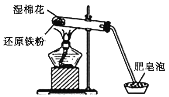
请回答下列问题:
(1)硬质试管中湿棉花的作用是________________。
(2)铁与水蒸气的反应中,氧化剂是________(填化学式,下同),还原剂是________。
(3)该同学对反应后硬质试管中固体物质的组成提出了如下假设:
假设1:只有Fe;
假设2:只有________;
假设3:既有Fe也有Fe3O4。
(4)为了验证反应后硬质试管中固体物质的组成,该同学进行了定量研究:反应前固体物质的质量为5.6 g,反应后固体物质的质量为6.6 g。从上述数据分析,反应后硬质试管中固体物质的组成为__________________。写出该反应的化学方程式________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的Na2O2与CO2反应,得到固体物质41.8 g,恰好与1 L 1 mol·L-1的稀盐酸完全反应。下列说法正确的是( )
A. 41.8 g固体物质为Na2CO3
B. 41.8 g固体物质为0.1 mol Na2CO3和0.4 mol Na2O2的混合物
C. 一定量的Na2O2为78 g
D. 41.8 g固体物质为31.2 g NaHCO3和10.6 g Na2CO3的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡CH3COOH![]() H++CH3COO-,不正确的是( )
H++CH3COO-,不正确的是( )
A. 醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
B. 常温下0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小
C. CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D. 常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将250mL含BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀。则原混合溶液中钾离子物质的量浓度为
A. 4(b-2a)mol/L B. 20(2a-b)mol/L
C. 20(b-2a)mol/L D. 10(b-a)mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式:
(1)苯酚钠溶液中通少量的CO2 :______。
(2)由甲苯制TNT :_____________。
(3)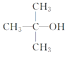 的消去反应:________。
的消去反应:________。
(4)![]() 的水解反应:______。
的水解反应:______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com