

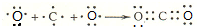 ,
,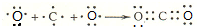 ;
;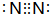 ,结构式为N≡N;K形成简单离子为Cl-,离子核外有18个电子,有3个电子层,各层电子数为2、8、8,离子结构示意图为:
,结构式为N≡N;K形成简单离子为Cl-,离子核外有18个电子,有3个电子层,各层电子数为2、8、8,离子结构示意图为: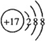 ,故答案为:第三周期ⅥA族;N≡N;
,故答案为:第三周期ⅥA族;N≡N; ;
;

科目:高中化学 来源: 题型:
| A、1mol氧含有6.02×1023个微粒 |
| B、阿伏加德罗常数数值约等于6.02×1023 |
| C、钠的摩尔质量等于它的相对原子质量 |
| D、1mol任何气体所含的气体分子数目,不一定都相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 和
和 ;⑥
;⑥ 和
和 ;⑦
;⑦ 和
和  ;⑧CH3-CH2-CH=CH2 和CH2-CH=CH-CH2.
;⑧CH3-CH2-CH=CH2 和CH2-CH=CH-CH2.查看答案和解析>>
科目:高中化学 来源: 题型:
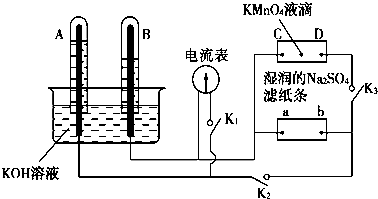
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,2.24L苯中约含有个NA碳原子 |
| B、标准状况下,22.4L H2中含中子数为2NA |
| C、1L 1mol/L醋酸溶液中离子总数为2NA |
| D、1mol Mg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度℃ | 25 | 80 | 230 |
| 平衡常数 | 5×10-4 | 2 | 1.9×10-5 |
| A、上述反应是熵增反应 |
| B、在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5mol?L-1,则此时反应逆向进行 |
| C、25℃时,反应Ni(CO)4(g)?Ni(s)+4CO(g)的平衡常数是0.5 |
| D、恒温恒容,向达平衡的容器中再充入少量Ni(CO)4(g),达新平衡时,CO的百分含量将减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2使酸性KMnO4溶液褪色 |
| B、Na2O2投入酚酞溶液中溶液先变红后褪色 |
| C、向FeSO4溶液中滴NaOH溶液,生成的沉淀由白色变成灰绿色,最后变成红褐色 |
| D、往紫色石蕊试液中通入氨气,溶液变蓝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com