
下列化学用语正确的是
A.18O2-结构示意图: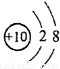
B.硝基苯的结构简式: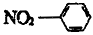
C.NaHSO4熔融时电离方程式:NaHSO4= Na++ HSO4-
D.模型 可表示甲烷分子或四氯化碳分子
可表示甲烷分子或四氯化碳分子
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源:2015-2016学年云南省高一下期中化学试卷(解析版) 题型:计算题
将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)=xC(g)+2D(g)经5分钟后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1mol/(L.min)。求:
(1)此时A的浓度c(A)= mol/L,反应开始前容器中A、B的物质的量为 mol.
(2)B的平均反应速率v(B)= mol/(L.min)。
(3)B的转化率为 。
(4)x= 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二下期中化学试卷(解析版) 题型:选择题
下列根据实验操作,所得出现象和结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向苯中加入溴水溶液,再加入适量铁粉 | 溶液变浑浊 | 生成溴苯 |
B | 向某溶液中滴加银氨溶液,再水浴加热 | 产生银镜 | 溶液中的物质一定是醛类 |
C | 将少量溴乙烷与NaOH溶液混合共热,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液 | 出现淡黄色沉淀 | 溴乙烷发生了水解 |
D | 向10 ml 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/L FeCl3溶液 | 白色沉淀转化为红褐色沉淀 | 证明在相同温度下的Ksp:Mg(OH)2﹥Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三5月四模化学试卷(解析版) 题型:选择题
25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
A.pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-)
B.0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3·H2O) > c(NH4+)> c(Cl-)> c(OH-)
C.0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
D.0.1 mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合: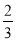 c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三5月四模化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A.等物质的量的MgC12、Ba(OH)2和HCl溶液混合:Mg2++2OH-=Mg(OH)2↓
B.用两个铜电极电解CuSO4溶液:2Cu2++2H2O 2Cu↓ +O2 ↑ +4H+
2Cu↓ +O2 ↑ +4H+
C.硫酸氢钠溶液与氢氧化钡溶液恰好反应呈中性:
H++SO42-+Ba2++OH一=H2O+BaSO4↓
D.向含有0.1 mol溶质的硫酸亚铁稀溶液中加入7.8 g Na2O2:
4Na2O2+4Fe 2+ + 6H2O= 4Fe(OH)3 + 8Na+ + O2↑
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三第五次模拟理综化学试卷(解析版) 题型:填空题
氢气是清洁的能源,也是重要的化工原料,根据以下两种制氢方法。完成下列问题:
(1)方法一:H2S热分解法,反应式为:2H2S(g)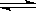 2H2(g)+S2(g)△H
2H2(g)+S2(g)△H
在恒容密闭容器中,测定H2S分解的转化率(H2S的起始浓度均为cmol/L),测定结果见右图,图中曲线a表示H2S的平衡转化率与温度关系,曲线表示不同温度下反应经过相同时间未达到化学平衡时H2S的转化率。
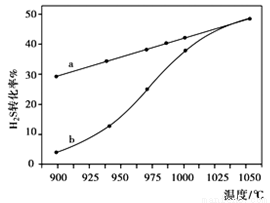
①△H______0,(“>”、“<”或“=”),
②若985℃时,反应经tmin达到平衡,此时H2S的转化率为40%,则tmin内反应速率v(H2)=______(用含c、t的代数式表示)。
③请说明随温度的升高,曲线b向曲线a接近的原因:______。
(2)方法二:以CaO为吸收体,将生物材质(以C计)与水蒸气反应制取H2.相关主要反应如下:
I:C(s)+H2O(g)═CO(g)+H2(g) △H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)═CO2(g)+H2(g) △H=-43kJ/mol
Ⅲ:CaO(s)+CO2(g)═CaCO3(s) △H=-178.3kJ/mol
①计算反应C(s)+2H2O(g)+CaO(s)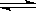 CaCO3(s)+2H2(g)的△H=______;
CaCO3(s)+2H2(g)的△H=______;
若K1、K2、K3分别为反应I、Ⅱ、Ⅲ的平衡常数,该平衡常数K=_____________(用K1、K2、K3表示)。
②对于可逆反应C(s)+2H2O(g)+CaO(s)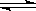 CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是______。(填字母编号)
CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是______。(填字母编号)
A.降低体系的温度
B.压缩容器的体积
C.适当增加水蒸气的通入量
D.增加CaO的量
③下图为反应I在一定温度下,平衡时各气体体积百分含量随压强变化的关系图。若反应达某一平衡状态时,测得c(H2O)=2c(H2)=2c(CO)=2mol/L,试根据H2O的体积百分含量变化曲线,补充完整CO的变化曲线示意图。

查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三第五次模拟理综化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列叙述正确的是
A.常温下,1L0.1mol/LNH4NO3溶液中的氮原子数为0.2NA
B.常温下,向含1molH2SO4的浓硫酸加入足量的铁粉,转移的电子数为2NA
C.标准状况下,2.24L己烷分子中含有1.9NA对共用电子
D.将1mol明矾晶体完全溶于水制成胶体,其中所含胶体微粒数目为NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古杭锦后旗奋斗中学高二下期中化学卷(解析版) 题型:填空题
在一密闭容器中(容积为2 L),充入氨气5 mol和氧气7.25 mol,并发生如下反应:4NH3+5O2 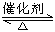 4NO+6H2O(g),此反应在一定条件下进行2 min后达到平衡,测得NH3的物质的量为4 mol.
4NO+6H2O(g),此反应在一定条件下进行2 min后达到平衡,测得NH3的物质的量为4 mol.
(1)生成H2O(g)的物质的量为 ,以NO的浓度变化表示该反应的平均反应速率是_______。
(2)O2的平衡浓度是____________。
(3)NH3的转化率为 。
(4)写出平衡常数的表达式 。
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三考前训练二理综化学试卷(解析版) 题型:填空题
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%,二氧化碳(CO2)的排放量也要大幅减少。
(1)在恒温,容积为1 L恒容中,硫可以发生如下转化,其反应过程和能量关系如图1所示(已知:2SO2(g)+O2(g)  2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
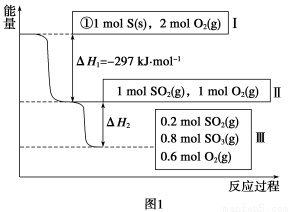
①写出能表示硫的燃烧热的热化学方程式:_________________________________。
②ΔH2=__________kJ·mol-1。
③在相同条件下,充入1 mol SO3和0.5 mol的O2,则达到平衡时SO3的转化率为______________;此时该反应________(填“放出”或“吸收”)________kJ的能量。
(2)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
①CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=________mol·L-1·min-1。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=________mol·L-1·min-1。
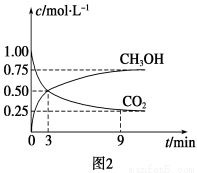
②能说明上述反应达到平衡状态的是________(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
③为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有________(填编号)。
A.升高温度 B.缩小容器体积 C.再充入CO2气体 D.使用合适的催化剂
(3)工业上,CH3OH也可由CO和H2合成。参考合成反应CO(g)+2H2(g)  CH3OH(g)的平衡常数。下列说法正确的是________。
CH3OH(g)的平衡常数。下列说法正确的是________。
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应ΔS<0
C.在T ℃时,1 L密闭容器中,投入0.1 mol CO和0.2 mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5 MPa)和250 ℃,是因为此条件下,原料气转化率最高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com