
【题目】煤燃烧产生的SO2是引起酸雨的原因之一。
(1)每隔一定时间测定某处雨水样品的pH值:
![]()
雨水样品pH值变小的主要原因是____________________。
(2)反应2SO2(g)+O2(g)![]() 2SO3(g)+Q (Q>0),其化学平衡常数表达式_______;升高温度,K____________(填“变大”或者“变小”)。
2SO3(g)+Q (Q>0),其化学平衡常数表达式_______;升高温度,K____________(填“变大”或者“变小”)。
(3)判断已达到化学平衡状态的描述是______(选填编号)。
a.体系的压强不再发生变化 | b.2υ正(SO2)=υ逆(O2) |
c.c(SO2) = c(SO3) | d.气体总质量不再变化 |
(4)防治酸雨常用的措施:向煤中加石灰,减少 SO2的产生。这种煤燃烧后,大部分硫元素最终转化为固体盐是_____________。
(5)把CO2气体通入澄清的石灰水,立即会产生浑浊,但把SO2气体通入澄清的石灰水,却不容易看到浑浊,而CaCO3和CaSO3都是难溶的电解质,试说明原因:_____________________。
(6)Na2SO3溶液呈碱性,可吸收尾气SO2。Na2SO3溶液呈碱性的原因(用离子方程式表示)_____________________;常温下,0.1mol/L该溶液中离子浓度由大到小排列___________(用离子符号表示)。
(7)常温下,NaHSO3溶液呈酸性,在Na2SO3溶液中滴加稀盐酸至中性时,溶质的主要成分有__________________。(用化学式表示)。
【答案】 雨水水样中的H2SO3被氧化为强酸H2SO4的原故。 K=[SO3]2/([SO2]2[O2]) 变小 a CaSO4 因为SO2在水中的溶解度比CO2大得多,而且H2SO3的酸性比H2CO3强, H+浓度大较快的生成酸式盐,所以通SO2于澄清的石灰水中极易过量,过量后生成Ca(HSO3)2而溶解。 SO32- +H2O ![]() OH-+HSO3-, HSO3- +H2O
OH-+HSO3-, HSO3- +H2O ![]() OH-+H2SO3(2分,写出第一步水解就给分) Na+ SO32- OH- HSO3- H + NaHSO3、Na2SO3、 NaCl
OH-+H2SO3(2分,写出第一步水解就给分) Na+ SO32- OH- HSO3- H + NaHSO3、Na2SO3、 NaCl
【解析】(1)SO2溶于水生成亚硫酸,亚硫酸易被氧化为强酸硫酸,因此雨水样品pH值变小;(2)根据反应2SO2(g)+O2(g)![]() 2SO3(g)+Q (Q>0)可知化学平衡常数表达式K=[SO3]2/([SO2]2[O2]);正反应放热,升高温度,平衡向逆反应方向进行,K变小;(3)a.正反应体积减小,体系的压强不再发生变化说明反应达到平衡状态,a正确;b.2υ正(SO2)=υ逆(O2)不能满足反应速率之比是相应的化学计量数之比,反应没有达到平衡状态,b错误;c.c(SO2) = c(SO3)不能说明正逆反应速率相等,不一定达到平衡状态,c错误;d.根据质量守恒定律可知气体总质量始终不变,d错误,答案选a。(4)防治酸雨常用的措施:向煤中加石灰,产生的SO2与氧化钙反应生成亚硫酸钙,亚硫酸钙被氧化生成硫酸钙,因此这种煤燃烧后,大部分硫元素最终转化为固体盐是CaSO4。(5)因为SO2在水中的溶解度比CO2大得多,而且H2SO3的酸性比H2CO3强, H+浓度大,能较快的生成酸式盐,所以通SO2通入澄清的石灰水中极易过量,过量后生成Ca(HSO3)2而溶解。(6)亚硫酸根离子水解,因此Na2SO3溶液呈碱性,离子方程式为SO32- +H2O
2SO3(g)+Q (Q>0)可知化学平衡常数表达式K=[SO3]2/([SO2]2[O2]);正反应放热,升高温度,平衡向逆反应方向进行,K变小;(3)a.正反应体积减小,体系的压强不再发生变化说明反应达到平衡状态,a正确;b.2υ正(SO2)=υ逆(O2)不能满足反应速率之比是相应的化学计量数之比,反应没有达到平衡状态,b错误;c.c(SO2) = c(SO3)不能说明正逆反应速率相等,不一定达到平衡状态,c错误;d.根据质量守恒定律可知气体总质量始终不变,d错误,答案选a。(4)防治酸雨常用的措施:向煤中加石灰,产生的SO2与氧化钙反应生成亚硫酸钙,亚硫酸钙被氧化生成硫酸钙,因此这种煤燃烧后,大部分硫元素最终转化为固体盐是CaSO4。(5)因为SO2在水中的溶解度比CO2大得多,而且H2SO3的酸性比H2CO3强, H+浓度大,能较快的生成酸式盐,所以通SO2通入澄清的石灰水中极易过量,过量后生成Ca(HSO3)2而溶解。(6)亚硫酸根离子水解,因此Na2SO3溶液呈碱性,离子方程式为SO32- +H2O![]() OH-+HSO3-,HSO3- +H2O
OH-+HSO3-,HSO3- +H2O![]() OH-+H2SO3;溶液显碱性,因此常温下,0.1mol/L该溶液中离子浓度由大到小排列Na+>SO32->OH->HSO3->H +。(7)在Na2SO3溶液中滴加稀盐酸至中性时,亚硫酸钠首先与盐酸反应生成亚硫酸氢钠和氯化钠。由于常温下,NaHSO3溶液呈酸性,所以盐酸不足,亚硫酸钠过量,则溶质的主要成分有NaHSO3、Na2SO3、 NaCl。
OH-+H2SO3;溶液显碱性,因此常温下,0.1mol/L该溶液中离子浓度由大到小排列Na+>SO32->OH->HSO3->H +。(7)在Na2SO3溶液中滴加稀盐酸至中性时,亚硫酸钠首先与盐酸反应生成亚硫酸氢钠和氯化钠。由于常温下,NaHSO3溶液呈酸性,所以盐酸不足,亚硫酸钠过量,则溶质的主要成分有NaHSO3、Na2SO3、 NaCl。


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:
【题目】检验SO2气体中是否混有CO2的方法是( )
A.先通过足量澄清石灰水,再通过足量品红溶液
B.先通过足量饱和NaHCO3溶液,再通过澄清石灰水
C.先通过足量NaOH溶液,再通过澄清石灰水
D.先通过足量酸性KMnO4溶液,再通过澄清石灰水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种气态烃,标况下的密度为1.25g/L,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。
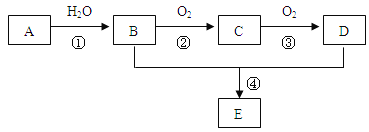
(1)写出A的结构简式 。
(2)B、D分子中所含官能团的名称分别是 、 。
(3)物质B可以直接氧化为D,需要加入的试剂是 。
(4)写出下列反应的化学方程式:
反应②的化学方程式: 。反应类型: ;
反应④的化学方程式: 。反应类型: ;
(5)B可由含淀粉的浓产品如玉米、小麦、薯类等经发酵、蒸馏而得。请写出淀粉水解的化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某温度时,在一个10 L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。

根据图中数据填空:
(1)该反应的化学方程式为_________________________________。
(2)反应开始至2 min,以气体Z表示的平均反应速率为____________________。
Ⅱ.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色。
(1)一定能证明2SO2(g)+O2(g) ![]() 2SO3(g)达到平衡状态的是__________(填序号,下同)。
2SO3(g)达到平衡状态的是__________(填序号,下同)。
(2)一定能证明I2(g) +H2(g) ![]() 2HI(g)达到平衡状态的是___________。
2HI(g)达到平衡状态的是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空
(1)按要求完成下列问题:
① 甲基的电子式_________;
② 写出制备TNT的化学方程式__________;
③写出2-溴丙烷消去反应的化学方程式__________;
④ 写出实验室制乙炔的化学方程式__________;
⑤![]() 含有的官能团的名称为__________;
含有的官能团的名称为__________;
(2)某有机物的结构简式为 据此填写下列空格。
据此填写下列空格。
① 该物质苯环上一氯代物有__________;
② lmol该物质和溴水混合,消耗Br2的物质的量为__________mol;
③ lmol该物质和H2加成需H2__________mol。
(3)![]() 与一定量的Br2发生加成反应,生成的产物可能是_______。
与一定量的Br2发生加成反应,生成的产物可能是_______。
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
(4)环蕃A(cyclophane)和超蕃B(superphane)是一种光电信息材料,都属于烃(B中氢原子未画出),它们的结构如图所示。

下列有关说法正确的是
A.环蕃和超蕃互为同系物 B.环蕃能使酸性高锰酸钾溶液褪色
C.环蕃能与液溴、硝酸发生取代反应 D.超蕃的一氯取代物只有l种,二氯取代物有3种
(5)实验证实,烯烃被酸性高锰酸钾溶液氧化时有如下规律:

己知某烃在通常情况下,只能跟等物质的量的溴反应:它与酸性高锰酸钾溶液反应时,所得氧化产物只有一种且没有支链,又知该烃充全燃烧时所需氧气的体积是相同悄况下烃蒸气的8.5倍,试分析该烃的结构简式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于![]() 下列结论正确的是
下列结论正确的是
A. 该有机物分子式为C13H16,属于苯的同系物
B. 该有机物密度比水小,与溴水混合后溶液分层,上层为橙红色
C. 该有机物分子至少有4个碳原子共直线,最多有13个碳原子共平面
D. 一定条件下,该有机物可发生取代、加成和氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,相互间一定互为同系物的是
A. 邻二甲苯和对二甲苯 B. C4H8 O2和C3H6O2
C. C4H10和C20H42 D. C6H5-OH和C6H5-CH2-OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com