
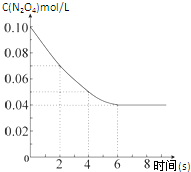
 在温度为298K时,将0.10mol无色的N2O4气体放入1L抽空的密闭容器中,出现红棕色,直至建立N2O4(g)?2NO2(g)的平衡.下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间).
在温度为298K时,将0.10mol无色的N2O4气体放入1L抽空的密闭容器中,出现红棕色,直至建立N2O4(g)?2NO2(g)的平衡.下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间).| T/K | 310 | 320 |
| K值 | 0.38 | 0.42 |
| △c |
| △t |
| △c |
| △t |
| (0.07mol?L-1-0.05mol?L-1)×2 |
| 2s |
 2NO2
2NO2| 0.06mol?L-1 |
| 0.1mol?L-1 |
| (0.12mol?L-1)2 |
| 0.04mol?L-1 |


科目:高中化学 来源: 题型:
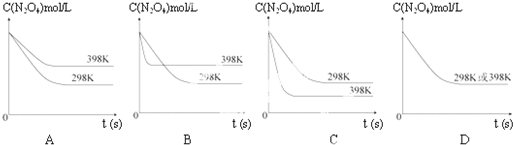
| A、①② | B、①③ | C、① | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 甲 | 乙 | 丙 | 丁 |
| 原子序数 | 6 | 8 | 11 | 13 |
| 元素符号 | ||||
| 周期 | ||||
| 族 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
| A | CO(g) | CO2(g) | NaOH溶液,浓H2SO4 | 洗气 |
| B | NH4Cl(aq) | Fe3+(aq) | NaOH溶液 | 过滤 |
| C | Cl2(g) | HCl(g) | 饱和食盐水,浓H2SO4 | 洗气 |
| D | Na2CO3(s) | NaHCO3(s) | -- | 灼烧 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com