
��15�֣��ǽ���Ԫ�ص��ж����������NO��NO2��N2O4�ȡ���֪NO2��N2O4�Ľṹʽ�ֱ��� ��
�� ��ʵ����N��N������Ϊ167kJ��mol��1��NO2�е���˫����ƽ������Ϊ466 kJ��mol��1��N2O4�е���˫����ƽ������Ϊ438.5 kJ��mol��1��
��ʵ����N��N������Ϊ167kJ��mol��1��NO2�е���˫����ƽ������Ϊ466 kJ��mol��1��N2O4�е���˫����ƽ������Ϊ438.5 kJ��mol��1��
��1��д��NO2ת��ΪN2O4���Ȼ�ѧ����ʽ_________________________________________
��2���Է�Ӧ2NO2
(g) N2O4 (g)�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ������˵����ȷ����(
)
N2O4 (g)�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ������˵����ȷ����(
)

A��A��C����ķ�Ӧ���ʣ�A��C
B��B��C����������ƽ����Է���������B��C
C��A��C�����������ɫ��A�Cdz
D����״̬B��״̬A�������ü��ȵķ���
��3����100��ʱ����0.400mol��NO2�������2 L��յ��ܱ������У�ÿ��һ��ʱ��ͶԸ������ڵ����ʽ��з������õ����±����ݣ�
|
ʱ�䣨s�� |
0 |
20 |
40 |
60 |
80 |
|
n(NO2)/mol |
0.40 |
n1 |
0.26 |
n3 |
n4 |
|
n(N2O4)/mol |
0.00 |
0.05 |
n2 |
0.08 |
0.08 |
�������������£��ӷ�Ӧ��ʼֱ��20 sʱ������������ƽ����Ӧ����Ϊ___ __��
��2NO2(g) N2O4(g)�÷�Ӧ��ƽ�ⳣ��K��ֵΪ
����100��ʱ��ijʱ�̲��c(NO2)=1.00mol/L,c(N2O4)=0.20mol/L�����ʱ�̵�v�� ���� v�����>������<����=�����������¶Ⱥ�Ӧ2NO2
N2O4(g)�÷�Ӧ��ƽ�ⳣ��K��ֵΪ
����100��ʱ��ijʱ�̲��c(NO2)=1.00mol/L,c(N2O4)=0.20mol/L�����ʱ�̵�v�� ���� v�����>������<����=�����������¶Ⱥ�Ӧ2NO2 N2O4��ƽ�ⳣ��K��
�����������С�����䡱����
N2O4��ƽ�ⳣ��K��
�����������С�����䡱����
��������ͬ����������������������N2O4���壬Ҫ�ﵽ����ͬ����ƽ��״̬��N2O4����ʼŨ����_____________mol��L��1��
�ܼ�����������´ﵽƽ����������ƽ����Է�������Ϊ____________�����������С�����һλ��
����15�֣�
��1��2NO2
(g) N2O4
(g)������H��-57 kJ��mol��1��2�֣�
N2O4
(g)������H��-57 kJ��mol��1��2�֣�
��2��D��2�֣�
��3����0.0025 mol��(L��s)-1����2�֣���������
��K��2.8��2�֣�������2�֣�����С��1�֣�
��0.10��2�֣�
��57.5��2�֣�
��������������̣����� N2O4  2NO2
2NO2
��ʼŨ��(mol��L��1) 0.10 0
ת��Ũ�ȣ�mol��L��1) 0.06 0.12
ƽ��Ũ��(mol��L��1)�� 0.04 0.12
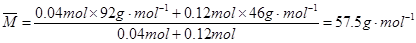



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ʡ����һ��2010��2011ѧ��߶���ѧ�����п��Ի�ѧ���� ���ͣ�022
| |||||||||||||||||||||||||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
��15�֣��ǽ���Ԫ�ص��ж����������NO��NO2��N2O4�ȡ���֪NO2��N2O4�Ľṹʽ�ֱ�����
��ʵ����N��N������Ϊ167kJ��mol��1��NO2�е���˫����ƽ������Ϊ466 kJ��mol��1��N2O4�е���˫����ƽ������Ϊ438.5 kJ��mol��1��
��1��д��NO2ת��ΪN2O4���Ȼ�ѧ����ʽ_________________________________________
��2���Է�Ӧ2NO2(g) N2O4 (g)�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ������˵����ȷ����( )
A��A��C����ķ�Ӧ���ʣ�A��C
B��B��C����������ƽ����Է���������B��C
C��A��C�����������ɫ��A�Cdz
D����״̬B��״̬A�������ü��ȵķ���
��3����100��ʱ����0.400mol��NO2�������2 L��յ��ܱ������У�ÿ��һ��ʱ��ͶԸ������ڵ����ʽ��з������õ����±����ݣ�
| ʱ�䣨s�� | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
�������������£��ӷ�Ӧ��ʼֱ��20 sʱ������������ƽ����Ӧ����Ϊ___ __��
��2NO2(g) N2O4(g)�÷�Ӧ��ƽ�ⳣ��K��ֵΪ ����100��ʱ��ijʱ�̲��c(NO2)=1.00mol/L,c(N2O4)=0.20mol/L�����ʱ�̵�v�� ���� v�����>������<����=�����������¶Ⱥ�Ӧ2NO2
N2O4��ƽ�ⳣ��K�� �����������С�����䡱����
��������ͬ����������������������N2O4���壬Ҫ�ﵽ����ͬ����ƽ��״̬��N2O4����ʼŨ����_____________mol��L��1��
�ܼ�����������´ﵽƽ����������ƽ����Է�������Ϊ____________�����������С�����һλ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012�콭��ʡ�����и��ʸ���ѧ�����ڶ��ο��Ի�ѧ�Ծ� ���ͣ������
��15�֣��ǽ���Ԫ�ص��ж����������NO��NO2��N2O4�ȡ���֪NO2��N2O4�Ľṹʽ�ֱ��� ��
�� ��ʵ����N��N������Ϊ167kJ��mol��1��NO2�е���˫����ƽ������Ϊ466 kJ��mol��1��N2O4�е���˫����ƽ������Ϊ438.5 kJ��mol��1��
��ʵ����N��N������Ϊ167kJ��mol��1��NO2�е���˫����ƽ������Ϊ466 kJ��mol��1��N2O4�е���˫����ƽ������Ϊ438.5 kJ��mol��1��
��1��д��NO2ת��ΪN2O4���Ȼ�ѧ����ʽ_________________________________________
��2���Է�Ӧ2NO2 (g) N2O4 (g)�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ������˵����ȷ����( )
N2O4 (g)�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ������˵����ȷ����( )
A��A��C����ķ�Ӧ���ʣ�A��C
B��B��C����������ƽ����Է���������B��C
C��A��C�����������ɫ��A�Cdz
D����״̬B��״̬A�������ü��ȵķ���
��3����100��ʱ����0.400mol��NO2�������2 L��յ��ܱ������У�ÿ��һ��ʱ��ͶԸ������ڵ����ʽ��з������õ����±����ݣ�
| ʱ�䣨s�� | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
 N2O4(g)�÷�Ӧ��ƽ�ⳣ��K��ֵΪ ����100��ʱ��ijʱ�̲��c(NO2)=1.00mol/L,c(N2O4)=0.20mol/L�����ʱ�̵�v�� ���� v�����>������<����=�����������¶Ⱥ�Ӧ2NO2
N2O4(g)�÷�Ӧ��ƽ�ⳣ��K��ֵΪ ����100��ʱ��ijʱ�̲��c(NO2)=1.00mol/L,c(N2O4)=0.20mol/L�����ʱ�̵�v�� ���� v�����>������<����=�����������¶Ⱥ�Ӧ2NO2 N2O4��ƽ�ⳣ��K�� �����������С�����䡱����
N2O4��ƽ�ⳣ��K�� �����������С�����䡱�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ���Ϻ���������������ѧ����ĩ��ѧ������⻯ѧ�Ծ��������棩 ���ͣ������
��һ�ٶ��ֻ�ѧԪ���У��ǽ���ռ��23�֡�80%�ķǽ���Ԫ���������ռ��Ҫλ�á���C��N��O��Si��Cl�ȡ�
��1����Ԫ��ԭ��������Ӳ����� ��������ͬ�ĵ��ӣ���Ԫ�صļ������Ӻ�������Ų�ʽ�� ��
��2���ɵ�Ԫ�����Ԫ����ɵ����ʣ����������췢���������Ȳ�������Ϊ������ ���壬��д���û�����Ļ�ѧʽ ��
��3��������ʵ��˵����������Ԫ�طǽ��������ǿ������ ����ѡ���ţ�
a��Clԭ������������������
b�����ԣ�HCl��H2O
c��ClO2����Ԫ��Ϊ+4�ۣ���Ԫ��Ϊ−2��
d���е㣺H2O��HCl
��Cl2��Ƚϣ�ClO2����ˮʱ����ԭ��Cl�����������л��ȴ�����к����ʡ���ҵ�Ͽ����������ƺ�ϡ����Ϊԭ���Ʊ�ClO2����Ӧ���£�NaClO2 +HCl ClO2��+___________________��û����ƽ��
ClO2��+___________________��û����ƽ��
��4����������ʽ�У�ȱ��������___________����ƽ����ʽ���������油ȫ��Ӧ��ϵ����____NaClO2 +____HCl
��5���÷�Ӧ���������ͻ�ԭ�������ʵ���֮���� ������0.2 mol ClO2ת�Ƶ��ӵ����ʵ���Ϊ _______ mol��
��6��ClO2����ˮ��Fe2����Mn2����S2����CN���������Ե�ȥ��Ч����ij��ˮ�к�CN��a mg/L������ClO2��CN��������ֻ�������������塣����100m3������ˮ��������ҪClO2 _______ mol ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com