
分析 ①向一份溶液中加入足量的NaOH浓溶液并加热,产生的气体在标准状况下体积为4.48L,应生成NH3,则一定含有NH4+,
②向另一份溶液中加入0.6mol/L的BaCl2溶液500mL,恰好可以与溶液中的离子完全反应,过滤得66.3g沉淀及滤液,沉淀可能为BaSO4或BaCO3或二者都有,如为BaSO4,
则m(BaSO4)=0.6mol/L×0.5L×233g/mol=69.9g,如为BaCO3,m(BaCO3)=0.6mol/L×0.5L×197g/mo=l59.1g,则说明甲中含有SO42-、CO32-;
③向上述沉淀中加入过量的盐酸,产生的气体通入足量澄清的石灰水中,得到一定量的沉淀X,则说明含有CO32-,则一定不存在Ca2+、Cu2+;
④向上述滤液中加入1mol/LAgNO3溶液650mL,恰好可完全反应,可知滤液中n(Cl-)=1mol/L×0.65L=0.65mol,而②加入n(Cl-)=0.6mol/L×2×0.5L=0.6mol,则说明甲中含有Cl-,以此解答该题.
解答 解:①向一份溶液中加入足量的NaOH浓溶液并加热,产生的气体在标准状况下体积为4.48L,应生成NH3,则一定含有NH4+,且n(NH4+)=$\frac{4.48L}{22.4L/mol}$=0.2mol;
②向另一份溶液中加入0.6mol/L的BaCl2溶液500mL,恰好可以与溶液中的离子完全反应,过滤得66.3g沉淀及滤液,沉淀可能为BaSO4或BaCO3或二者都有,如为BaSO4,
则m(BaSO4)=0.6mol/L×0.5L×233g/mol=69.9g,如为BaCO3,m(BaCO3)=0.6mol/L×0.5L×197g/mo=l59.1g,则说明甲中含有SO42-、CO32-,设分别为xmol,为ymol,
则$\left\{\begin{array}{l}{x+y=0.3}\\{233x+197y=66.3}\end{array}\right.$,x=0.2,y=0.1;
③向上述沉淀中加入过量的盐酸,产生的气体通入足量澄清的石灰水中,得到一定量的沉淀X,则说明含有CO32-,则一定不存在Ca2+、Cu2+;
④向上述滤液中加入1mol/LAgNO3溶液650mL,恰好可完全反应,可知滤液中n(Cl-)=1mol/L×0.65L=0.65mol,而②加入n(Cl-)=0.6mol/L×2×0.5L=0.6mol,则说明甲中含有Cl-,且n(Cl-)=0.65mol-0.6mol=0.05mol,如不含NO3-,则由电荷守恒可知一定含有K+,由n(K+)+n(NH4+)=2n(CO32-)+2n(SO42-)+n(Cl-),
则n(K+)=2×0.1mol+2×0.2mol+0.05mol-0.2mol=0.45mol,
因分成两份,则甲含有0.4molNH4+、0.9molK+、0.4molSO42-、0.2molCO32-、0.1molCl-,如含有NO3-,则K+大于0.9mol,
(1)上述实验③中得到沉淀X为碳酸钙,质量为0.1mol×100g/mol=10g,生成沉淀X的离子方程式为Ca2++CO2+2OH-=CaCO3↓+H2O,
故答案为:10g;Ca2++CO2+2OH-=CaCO3↓+H2O;
(2)由以上分析可知一定不存在Ca2+、Cu2+,不能确定是否含有NO3-,故答案为:Ca2+、Cu2+;NO3-;
(3)甲含有0.4molNH4+、0.9molK+、0.4molSO42-、0.2molCO32-、0.1molCl-,如含有NO3-,则K+大于0.9mol,
则物质的量最大的离子是K+;物质的量最小的离子是Cl-,此物质的量最小的离子其物质的量为0.1mol.
故答案为:K+;Cl-;0.1mol.
点评 本题考查物质的鉴别以及混合物的计算,为高考常见题型,侧重于学生的分析、计算能力的考查,注意利用反应的不同现象来区分是解答的关键,明确无机物之间的反应即可解答,题目难度中等.


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:解答题
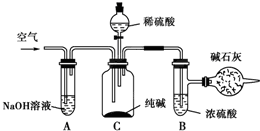 工业纯碱中常含有NaCl、Na2SO4等杂质,可用如下图所示的装置测定工业纯碱中有效成分的含量.实验过程的主要步骤是:
工业纯碱中常含有NaCl、Na2SO4等杂质,可用如下图所示的装置测定工业纯碱中有效成分的含量.实验过程的主要步骤是:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将颗粒状锶单质放入水中,反应剧烈,生成大量的气体,气体燃烧且发生轻微爆炸 | |
| B. | 颗粒状锶单质与稀硫酸反应,反应现象不如钠与水反应剧烈 | |
| C. | 锶在纯氧中可以燃烧,燃烧产物与水反应生成的氢氧化物为强碱 | |
| D. | 锶在纯净氮气中可以燃烧,燃烧产物与水反应可以放出气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测定值一定有误差 | |
| B. | 测定值一定没有误差 | |
| C. | 测出的Na2CO3溶液的pH偏小 | |
| D. | 用此方法测H+浓度相同的盐酸和醋酸时,盐酸的pH比醋酸小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
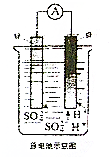 如图所示,将铜片、锌片用导线连接后置于同一稀硫酸中形成原电池,下列相关叙述正确的是( )
如图所示,将铜片、锌片用导线连接后置于同一稀硫酸中形成原电池,下列相关叙述正确的是( )| A. | 锌片是原电池负极 | B. | 溶液逐渐变为蓝色 | ||
| C. | H+在负极得到电子被还原 | D. | 锌片越纯,锌片上产生的气泡越多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Ca、Mg、Al、K | B. | Na、K、Zn、Fe、Hg | C. | Zn、Fe、Cu、Ag、Sn | D. | Mg、Al、Zn、Fe、Pb |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO32-+OH-+2H+═HCO3-↑+H2O | B. | CO32-+2OH-+3H+═HCO3-+2H2O | ||
| C. | CO32-+2OH-+4H+═CO2↑+3H2O | D. | CO32-+OH-+3H+═CO2↑+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com