
分析 (1)固体或纯液体物质,物质的量增加减少不影响化学平衡;
(2)反应物、生成物气体体积不变,化学计量数之和相等;
(3)增大压强,平衡向着体积减小的方向移动;
(4)升高温度,化学平衡向着吸热方向移动.
解答 解:(1)A量的增减,平衡不移动,说明A是固体或纯液体,固体的物质的量不影响化学平衡,故答案为:固或液;
(2)增压,平衡不移动,说明反应两边气体的体积相等,气体的化学计量数之和相等:当n=2时,A只能是非气体;当n=3时,A必须是气体,
故答案为:固或液;气;
(3)若A为固体,增大压强,C的组分含量减少,平衡向着逆向移动,逆向是体积减小的方向,所以n≥3,故答案为:n≥3;
(4)升温,平衡向着吸热反应方向移动,所以正反应方向是吸热反应,该反应的逆反应是放热反应,故答案为:放热.
点评 本题考查了影响化学平衡的因素,注意题目要求,如第四问容易马虎出错,注意固体或纯液体物质不受压强的影响.


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:解答题
 现有反应:A、CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑
现有反应:A、CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
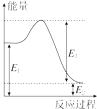 甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.
甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能 (kJ•mol-1) | 348 | 413 | 436 | 358 | 1072 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 原子半径大小为:B>A>C | B. | 核电荷数:D>C>B>A | ||
| C. | A与D形成的化合物均是离子键 | D. | 生成的氢化物的稳定性为:D>A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
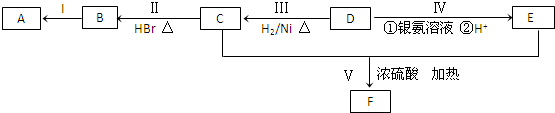
 .
. .
. ;②
;②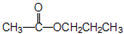 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
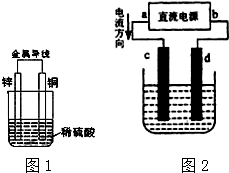 (1)请指出锌电极和c电极的电极名称:(正、负、阴、阳)
(1)请指出锌电极和c电极的电极名称:(正、负、阴、阳)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com