
| A. | 4.8g | B. | 5.4g | C. | 6.0g | D. | 6.6g |
分析 根据气体的体积差,通过差量法计算参加反应的二氧化碳体积、生成的氧气的体积,判断3.36L气体的组成及各成分的体积,再根据n=$\frac{V}{{V}_{m}}$计算各组分气体的物质的量,利用m=nM计算质量.
解答 解:令参加反应的CO2气体的体积为a,生成的O2的体积为b,则:
2CO2+2Na2O2=2Na2CO3+O2 气体体积减小△V
2 1 1
a b 4.48L-3.36L=1.12L
解得:a=2.24L,b=1.12L,
生成氧气的体积1.12L,参加反应二氧化碳2.24L,所以3.36L气体中CO2体积为4.48L-2.24L=2.24L,
所以3.36L气体的质量为$\frac{2.24L}{22.4L/mol}$×44g/mol+$\frac{1.12L}{22.4L/mol}$×32g/mol=6.0g,
故选C.
点评 本题考查根据方程式的计算,难度中等,本题采取差量法计算,可以避免单独讨论或计算判断最后气体的组成,注意差量法的理解与运用.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCH4中含有氢原子数目为4NA | |
| B. | 1molNa2O2中含有的阴离子和阳离子的数目为2NA | |
| C. | 0.1mol/LCu(NO3)2溶液中含有的NO3-数目为0.2NA | |
| D. | 28gN2中所含的原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH-CH3 | B. | C6H5-CH=CH2 | C. | C6H5-CH3 | D. | CH2=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
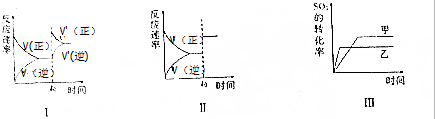
| A. | 图Ⅰ研究的是t0时刻增大O2的浓度对反应速率的影响 | |
| B. | 图Ⅱ研究的是t0时刻加入催化剂后对反应速率的影响 | |
| C. | 图Ⅲ研究的是压强对化学平衡的影响,且乙的压强比甲高 | |
| D. | 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度比甲高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在密闭容器中加入l.5mol H2和0.5molN2,充分反应后可得到NH3分子数为NA | |
| B. | 一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数为0.1NA | |
| C. | 7.1gCl2与足量的氢氧化钠溶液反应转移的电子数为0.2NA | |
| D. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
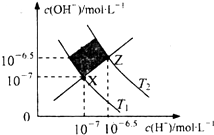
| A. | XZ线上任意点均表示溶液的pH=7 | |
| B. | 图中T1>T2 | |
| C. | M区域对应溶液中大量存在:Fe3+、Na+、C1-、SO42- | |
| D. | Z点对应的可能是CH3COOH和CH3COONa的混合液,且c(CH3COO-)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述I | 叙述II |
| A | 用酸度计测定SO2和CO2饱和溶液的pH,前者pH小 | 结论:说明H2SO3酸性强于H2CO3 |
| B | SiO2是酸性氧化物 | SiO2不与任何酸溶液反应 |
| C | 配制SnCl2溶液时,先将SnCl2溶于适量的稀盐酸中,再用蒸馏水稀释,保存时再在试剂瓶中加入少量的锡粒 | 抑制Sn2+水解,并防止Sn2+被氧化为Sn4+ |
| D | 浓硝酸具有强氧化性 | 应保存在棕色玻璃试剂瓶中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com