
 2NH3��g����H��0����ƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
2NH3��g����H��0����ƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���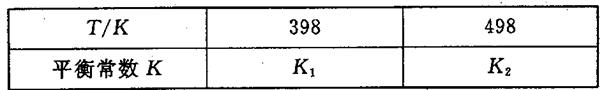
 2H2O��l�� ��H����483��6 kJ��mol
2H2O��l�� ��H����483��6 kJ��mol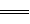 2NO2��g�� ��H����67��8 kJ��mol
2NO2��g�� ��H����67��8 kJ��mol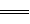 2NH3��g�� ��H����92��0 kJ��mol
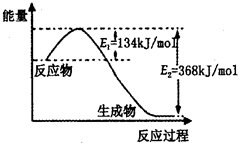
2NH3��g�� ��H����92��0 kJ��mol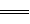 2NH3��g��֪��ת���ĵ��������ʵ���Ϊ0.2mol��������ת����Ϊ10%��������߰����IJ��ʣ����ݻ�ѧƽ���ƶ�ԭ������������Ľ��飺����Ӧ���Ũ�ȡ����¡�����ѹǿ�ȣ���2�������ͼ��֪���÷�Ӧ���ʱ��H=E1��E2=134KJ/mol��368KJ/mol=��234KJ/mol���Ȼ�ѧ����ʽΪNO2��g��+CO��g��=CO2��g��+NO��g����H=��234 kJ��mol����3���ٸ��ݻ�ѧƽ�ⳣ���Ķ���д����K=c2(NH3)/ c(N2) c3(H2)���ںϳɰ��ķ�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���ƽ�ⳣ����С������K1��K2���۸��ݸ�˹���ɣ��١�3+�ڡ�2���ۡ�2�ã�4NH3��g����7O2��g����4NO2��g����6H2O��l������H=��1131.2 kJ��mol�����ȼ���ȵĶ���֪��NH3��g����ȼ����282.8kJ��mol��
2NH3��g��֪��ת���ĵ��������ʵ���Ϊ0.2mol��������ת����Ϊ10%��������߰����IJ��ʣ����ݻ�ѧƽ���ƶ�ԭ������������Ľ��飺����Ӧ���Ũ�ȡ����¡�����ѹǿ�ȣ���2�������ͼ��֪���÷�Ӧ���ʱ��H=E1��E2=134KJ/mol��368KJ/mol=��234KJ/mol���Ȼ�ѧ����ʽΪNO2��g��+CO��g��=CO2��g��+NO��g����H=��234 kJ��mol����3���ٸ��ݻ�ѧƽ�ⳣ���Ķ���д����K=c2(NH3)/ c(N2) c3(H2)���ںϳɰ��ķ�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���ƽ�ⳣ����С������K1��K2���۸��ݸ�˹���ɣ��١�3+�ڡ�2���ۡ�2�ã�4NH3��g����7O2��g����4NO2��g����6H2O��l������H=��1131.2 kJ��mol�����ȼ���ȵĶ���֪��NH3��g����ȼ����282.8kJ��mol��

 �ִʾ�ƪ��ͬ�����Ĵ��ϵ�д�
�ִʾ�ƪ��ͬ�����Ĵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| A����ӦO3+ O=2O2�Ħ�H=E1-E2 |
| B����ӦO3+ O=2O2�Ħ�H=E2-E3 |
| C����ӦO3+ O= 2O2�����ȷ�Ӧ |
| D����ӦO3+ O=2O2�Ħ�H=��H1+��H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
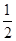 O2(g)=H2O(g) ��H1����241.8 kJ��mol��1
O2(g)=H2O(g) ��H1����241.8 kJ��mol��1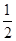 O2(g)=CO(g) ��H2����110.5 kJ��mol��1
O2(g)=CO(g) ��H2����110.5 kJ��mol��1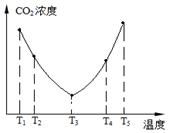
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
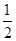 O2(g) ===CO(g)����H1 C(s)+O2(g) ===CO2(g)����H2
O2(g) ===CO(g)����H1 C(s)+O2(g) ===CO2(g)����H2| A���� | B���٢� | C���٢� | D���ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
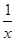 Sx��s�� ��H��akJ/mol
Sx��s�� ��H��akJ/mol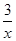 Sx��s�� ��H��bkJ/mol��
Sx��s�� ��H��bkJ/mol��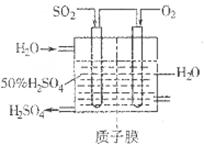
 2SO3��g�� ��H��0��SO2��ת�����ǿ���SO2�ŷŵĹؼ���ʩ֮һ��ij����С�����������̽����
2SO3��g�� ��H��0��SO2��ת�����ǿ���SO2�ŷŵĹؼ���ʩ֮һ��ij����С�����������̽���� 2SO3��g����Ӧ��Ӱ�죬ʵ������ͼ��ʾ����ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ���������a��b��c����������ƽ��״̬�У�SO2��ת������ߵ���____���¶�T1______T2���������������������
2SO3��g����Ӧ��Ӱ�죬ʵ������ͼ��ʾ����ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ���������a��b��c����������ƽ��״̬�У�SO2��ת������ߵ���____���¶�T1______T2���������������������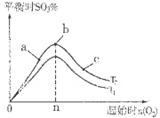
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
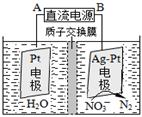
 2NH3 ��H ="-92.4" kJ/mol,��ʼ���ǽ�N2��H2�������20mol (�����1��1)����5L�ϳ�����.��ӦǰѹǿΪP0,��Ӧ������ѹǿ��P��ʾ����Ӧ������P/P0��ʱ��t�Ĺ�ϵ��ͼ��ʾ����ش��������⣺
2NH3 ��H ="-92.4" kJ/mol,��ʼ���ǽ�N2��H2�������20mol (�����1��1)����5L�ϳ�����.��ӦǰѹǿΪP0,��Ӧ������ѹǿ��P��ʾ����Ӧ������P/P0��ʱ��t�Ĺ�ϵ��ͼ��ʾ����ش��������⣺
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3OH(g) ��H
CH3OH(g) ��H| ��ѧ�� | C��C | C��H | H��H | C��O | C��O | H��O |
| ����/kJ��mol��1 | 348 | 413 | 436 | 358 | 1072 | 463 |
| ��Ӧʱ��/min | 0 | 5 | 10 | 15 | 20 | 25 |
| ѹǿ/MPa | 12��6 | 10��8 | 9��5 | 8��7 | 8��4 | 8��4 |
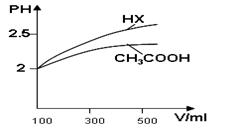
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3OH(g) ��H1
CH3OH(g) ��H1 CH3OH(g) + H2O(g) ��H2
CH3OH(g) + H2O(g) ��H2| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
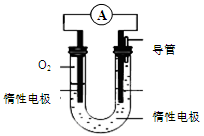
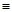 N������941kJ��������1molN4����ת��Ϊ2molN2ʱҪ�ų�______________ kJ������
N������941kJ��������1molN4����ת��Ϊ2molN2ʱҪ�ų�______________ kJ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com