
设NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,11.2 L氧气所含的O原子数为NA B.1mol/L的CaCl2溶液中含有的Cl-为2NA
C.2.4g镁变成Mg2+时失去的电子数目为0.2NA D.7.8 g Na2O2中含有的阴离子数目为0.2 NA
科目:高中化学 来源: 题型:
在无色透明的溶液中可以大量共存的离子组是 ( )
A. Mg2+、K+、Cl-、NO3- B.OH-、Cl-、Na+、NH4+
C.H+、K+、Fe2+、NO3- D.I-、Cl-、H+、Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各溶液中氯离子(Cl-)的物质的量浓度最大的是( )
A.200 mL 0.5mol·L-1的FeCl3溶液 B.100 mL 0.5mol·L-1的MgCl2溶液
C.150 mL 1mol·L-1的NaCl溶液 D.50 mL 0.5mol·L-1的CuCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验现象的描述错误的是( )
A.CuSO4溶液不能产生丁达尔现象,Fe(OH)3胶体能产生丁达尔现象
B.向石蕊试液中加入新制氯水,石蕊试液变红后一直保持
C.向淀粉Kl溶液中滴加少量新制氯水,溶液变蓝色
D.在新制氯水和久置氯水中滴加AgNO3溶液都有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于应用套管实验装置(部分装置未画出)进行的实验,叙述错误的是 ( )
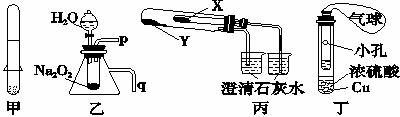
A.利用甲装置可以制取少量H2
B.利用乙装置可以验证Na2O2与水反应既生成氧气,又放出热量
C.利用丙装置验证NaHCO3和Na2CO3的热稳定性,X中应放的物质是K2CO3
D.利用丁装置制取SO2,并检验其还原性,小试管中的试剂可为酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
实验探究和推理都是科学研究的基本方法,请你对以下实验进行探究和推理
Ⅰ.有一瓶澄清的溶液,其中可能含有H+、NH4+、K+、Na+、Mg2+、Ba2+、Fe3+、SO42―、CO32―、Cl―和I―。取该溶液进行了以下实验:
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入CCl4及数滴氯水,经振荡后CCl4层呈紫红色;
(3)另取部分溶液,加入稀NaOH 溶液使其变为碱性,溶液中无沉淀生成;
(4)取部分上述碱性溶液,加Na2CO3溶液有白色沉淀生成;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使润湿的红色石蕊试纸变蓝;
根据上述实验事实,你可知道该溶液中
①肯定含有的离子除了H+、Ba2+,还有 ;
②肯定不存在的离子除了Mg2+、CO32-,还有 ;
③还不能确定是否存在的离子除了Na+,还有 ;
Ⅱ.兴趣小组通过实验探究溶解铜的方法和本质。
在热水浴中进行3个实验,部分实验报告如下表所示。
| 序号 | 实验操作 | 实验现象 |
| I | 稀硫酸中加入铜片 | 无明显变化 |
| II | 硝酸钠溶液中加入铜片 | 无明显变化 |
| III | 稀硫酸中加入硝酸钠溶液 | 无明显变化 |
| 再加入铜片 | 有无色气泡;溶液变蓝 |
① 实验I、II的目的是 。
② 实验III中反应的本质是(用离子方程式表示) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
当氢氧化钠固体在水中溶解达到平均时,Mg(OH)2  Mg2++2OH-,为使氢氧化钠固体量减少,需加入少量的( )
Mg2++2OH-,为使氢氧化钠固体量减少,需加入少量的( )
(A)Na2S (B)MgSO4 (C)NH4NO3 (D)NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)恒温下,向一个2L的密闭容器中充入1moN2和2.6molH2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:

此条件下,该反应达到化学平衡时,氮气的浓度为_______,平衡常数K=_________。
(2)如下图所示,装置1为甲烷燃料电池(电解质溶液为KOH溶液),通过装置II实现铁棒上镀铜。


①b处电极上发生的电极反应式是______________。
②电镀结束后,装置I中溶液的pH______,装置II中Cu2+的物质的量浓度_________。填(“变大”“变小”或“不变”)
③若完全反应后,装置II中阴极质量增加12.8g,则装置I中理论上消耗甲烷______I.(标准状况下)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com