
2012年5月30日,国际理论与应用化学联合会正式确定了第114号和第116号元素的名称。下列有关这两种元素的说法错误的是 ( )
A.两种元素位于同一周期
B.116号元素位于第ⅥA族
C.两种元素都是活泼的非金属元素
D.114号元素的原子半径比116号元素的大
科目:高中化学 来源: 题型:
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
A.氯水的颜色呈浅绿色,说明氯水中含有Cl2
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述错误的是
A. SO2使溴水褪色与乙烯使KMnO4溶液褪色的原理相同
B.制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸
C.用饱和食盐水替代水跟电石反应,可以减缓乙炔的产生速率
D.用AgNO3溶液可以鉴别KC1和KI
查看答案和解析>>
科目:高中化学 来源: 题型:
NH3经一系列反应可以得到HNO3,如下图所示。
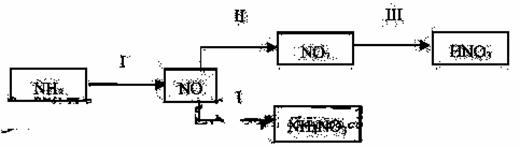
 (1)I中,NH3 和O2在催化剂作用下反应,其化学方程式是_____________________。
(1)I中,NH3 和O2在催化剂作用下反应,其化学方程式是_____________________。
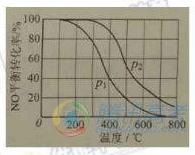
(2)II中,2NO(g)+O2 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如右图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如右图)。
①比较P1、P2的大小关系:________________。
②随温度升高,该反应平衡常数变化的趋势是________________。
(3)III中,将NO2(g)转化为N2O4(l),再制备浓硝酸。
①已知:2NO2(g) N2O4(g)△H1
N2O4(g)△H1
2NO2(g) N2O4(l)△H2
N2O4(l)△H2
下列能量变化示意图中,正确的是(选填字母)_______________。
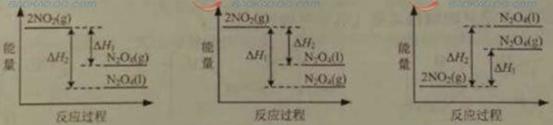
A B C
②N2O4与O2、H2O化合的化学方程式是_________________。
(4)IV中,电解NO制备 NH4NO3,其工作原理如右图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是_____________,说明理由:________________。
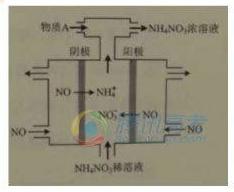
查看答案和解析>>
科目:高中化学 来源: 题型:
答案 C
解析 本题常因对元素周期表的结构掌握不牢固造成错误。根据元素周期表中每周期所含有的元素的种类数分别为2、8、8、18、18、32,分析比较得出C符合题意。
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:________________________________________________________________________
与盐酸反应最剧烈,___________ _______与盐酸反应最慢。
_______与盐酸反应最慢。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由:________________________________________________________________________
________________________________________________________________________。
Ⅱ.利用下图装置可以验证非金属性的变化规律。
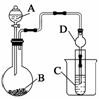
(3)仪器A的名称为________,干燥管D的作用是____________________________。
(4)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫:装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为________________________________________________________________________。
(5)若要证明非金属性:C>Si,则A中加________、B中加Na2CO3、C中加________,观察到C中溶液的现象为________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为13。X的原子半径比Y的小,X与W同主族,Z是地壳中含量最高的元素。下列说法正确的是 ( )
A.原子半径的大小顺序:r(Y)>r(Z)>r(W)
B.元素Z、W的简单离子的电子层结构不同
C.元素Y的简单气态氢化物的热稳定性比Z的强
D.只含X、 Y、Z三种元素的化合物,可能是离子
Y、Z三种元素的化合物,可能是离子 化合物,也可能是共价化合物
化合物,也可能是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
四种短周期元素A、B、C、D的性质或结构信息如下:
信息:①原子半径:A>B>C>D ②四种元素之间形成的某三种分子的比例模型及部分性质如下:
甲: 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二。
是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二。
乙: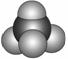 无色,无气味并且易燃。是常见的一种基础能源。
无色,无气味并且易燃。是常见的一种基础能源。
丙: 有强氧化性的弱酸,可以用于消毒杀菌。
有强氧化性的弱酸,可以用于消毒杀菌。
请根据上述信息回答下列问题。
(1)B元素在周期表中的位置________________,请写出BC2分子的电子式________________。
(2)A所在周期中,E元素的单质还原性最强,F元素的某些盐类常用作净水剂。E单质与甲反应有化合物X生成。请写出以下两个反应的离子方程式:
①A元素的单质与物质甲发生的反应______________________________________。
②F、C两种元素组成的化合物Y可作为高温结构陶瓷材料,X与Y两种化合物在溶液中发生的反应___________________________________________________________。
(3)物质丁的元素组成和甲相同,丁分子具有18电子结构。向盛有一定浓度溶液的试管中,逐滴加入用少量稀硫酸酸化的硫酸亚铁溶液。滴加过程的现象是:
①浅绿色溶液变成深棕黄色,②有少量气泡出现(经验证是氧气),片刻后反应变得剧烈,并放出较多热量,继续滴加溶液,静置一段时间,③试管底部出现红褐色沉淀。向浊液中再滴入稀硫酸,沉淀溶解,溶液呈黄色。请用化学方程式或离子方程式及必要的文字解释①、②、③中加点的字。
①______________,②______________,③____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各对物质中互为同系物的是( )
A.CH3-CH=CH2和CH3-CH2-CH=CH2 B.CH3-CH3和CH3-CH=CH2
C.CH3-CH2-CH3和CH3-CH=CH2 D.CH3-CH2-CH2=CH2和CH3-CH2-CH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com