
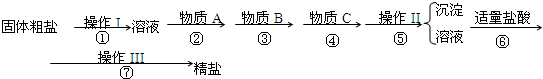
(12分)为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
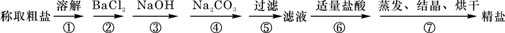
(1)第⑤步实验操作需要烧杯、____________、___________等玻璃仪器。
(2)步骤2中,判断加入BaCl2已过量的方法是:
(3)除杂试剂BaCl2 、NaOH、Na2CO3、加入的顺序还可以是(用化学式回答) 。
(4)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是_____________________________。
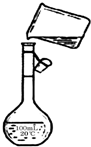
(5)为检验精盐纯度,需配制200 mL 1 mol/L NaCl(精盐)溶液,下图是该同学转移溶液的示意图,图中的错误是:
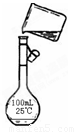
(6)配制过程中,下列操作情况会使结果偏低的是
A.称量时,托盘天平左盘加砝码,右盘加氯化钠
B.移液前,容量瓶中有少量蒸馏水未倒出
C.定容时,俯视容量瓶刻度线观察液面
D.定容后,倒置容量瓶摇匀经平放静置,液面低于刻度线,再加水定容
(12分,第一题一空1分,其余每空2分)
(1)玻璃棒 漏斗
(2)在②步后的上层清液中,再滴入BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量(其它合理答案也可) 2分
(3)NaOH、BaCl2、Na2CO3或BaCl2、Na2CO3、NaOH 2分
(4)在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度 2分
(5)未用玻璃棒引流;未用200mL容量瓶。2分
(6)AD 各1分,共2分多选、错选不得分。
【解析】(1)步骤⑤是过滤,需要的玻璃仪器是烧杯、玻璃棒和漏斗。
(2)判断加入BaCl2已过量的方法是继续加入氯化钡溶液,即在②步后的上层清液中,再滴入BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量。
(3)考查物质的分离和提纯。Ca2+用碳酸钠除去,Mg2+和铁离子用氢氧化钠除去,SO42-用氯化钡除去,最后加入盐酸酸化。但用于过量的氯化钡要用碳酸钠来除,所以碳酸钠必需放在氯化钡的后面,而氢氧化钠可以随意调整,即NaOH、BaCl2、Na2CO3或BaCl2、Na2CO3、NaOH。
(4)若先用盐酸调pH值再过滤,则在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度。
(5)根据示意图可知,存在的错误是未用玻璃棒引流和未用200mL容量瓶。
(6)根据c=n/V可知,称量时,托盘天平左盘加砝码,右盘加氯化钠,则溶质的质量减少,浓度偏小;移液前,容量瓶中有少量蒸馏水未倒出,不影响实验结果;定容时,俯视容量瓶刻度线观察液面,则容量瓶中溶液的体积减少,浓度偏高;定容后,倒置容量瓶摇匀经平放静置,液面低于刻度线,再加水定容,则容量瓶中溶液的体积增加,浓度偏小,所以答案选AD。


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 aOH溶液 b、KOH溶液 c、BaCl2溶液 d、Ba(NO3)2溶液
aOH溶液 b、KOH溶液 c、BaCl2溶液 d、Ba(NO3)2溶液查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com