
某小组为研究电化学原理,设计如图装置。下列叙述正确的是( )
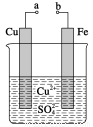
A.a和b用导线连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为2H++2e-=H2↑
C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极
移动
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014高考化学二轮专题突破 专题十五综合实验探究练习卷(解析版) 题型:实验题
3,5?二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5?二甲氧基苯酚的部分物理性质见下表:
物质 | 沸点/℃ | 熔点/℃ | 密度(20 ℃) /g·cm-3 | 溶解性 |
甲醇 | 64.7 | — | 0.791 5 | 易溶于水 |
乙醚 | 34.5 | — | 0.713 8 | 微溶于水 |
3,5?二甲氧基苯酚 | — | 33~36 | — | 易溶于甲醇、乙醚,微溶于水 |
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。①分离出甲醇的操作是________________。②萃取用到的分液漏斗使用前需________并洗净,分液时有机层在分液漏斗的________(填“上”或“下”)层。
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3溶液洗涤的目的是________;用饱和食盐水洗涤的目的是________________________。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是________(填字母)。
a.蒸馏除去乙醚 b.重结晶
c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤。为了防止倒吸,减压过滤完成后应先________,再________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十一常见金属元素练习卷(解析版) 题型:选择题
实验室中使用铝盐制备氢氧化铝,为了使其中的铝元素完全转化为目标产物,应该选用的试剂是( )
A.碳酸 B.稀硫酸 C.氢氧化钠溶液 D.氨水
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题八电化学练习卷(解析版) 题型:填空题
以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎。
Ⅱ.采用如下装置进行电化学浸出实验
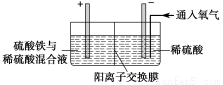
将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:2RH(有机相)+Cu2+(水相)  R2Cu(有机相)+2H+(水相)
R2Cu(有机相)+2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ.电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2+4H+=Cu2++Fe2++2H2S
2Fe3++H2S=2Fe2++S↓+2H+
①阳极区硫酸铁的主要作用是____________。
②电解过程中,阳极区Fe3+的浓度基本保持不变,原因是______________________。
(2)阴极区,电极上开始时有大量气泡产生,后有固体析出,一段时间后固体溶解。写出上述现象对应的反应式____________________。
(3)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是__________;加入有机萃取剂的目的是__________。
(4)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是____________。
(5)步骤Ⅳ,若电解200 mL 0.5 mol·L-1的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是__________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题八电化学练习卷(解析版) 题型:选择题
太阳能光伏发电系统是被称为“21世纪绿色光源”的半导体照明(LED)系统(如图)。已知发出白光的LED是将GaN芯片和钇铝石榴石(YAG,化学式:Y3Al5O12)芯片封装在一起做成。下列说法中不正确的是( )
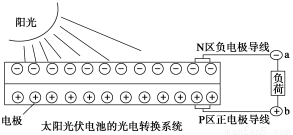
A.光伏发电是将太阳能转变为电能
B.上图中N区半导体为负极,P区半导体为正极,电流从a流向b
C.YAG中钇显+3价
D.Ga与N在元素周期表中不处于同一主族
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题五离子反应练习卷(解析版) 题型:选择题
某pH=1的工业废液,只可能含有以下离子中的若干种:H+、Mg2+、Ba2+、Cl-、CO32-、SO42-,现取两份100 mL溶液进行如下实验:
第一份加入足量AgNO3溶液,得干燥沉淀3.50 g。
第二份加足量BaCl2溶液后,得干燥沉淀2.33 g,经足量盐酸洗涤、干燥后,沉淀质量不变。
根据上述实验,以下推测正确的是( )
①一定存在Mg2+ ②可能存在CO32- ③一定存在Cl- ④可能存在Ba2+ ⑤可能存在Mg2+
A.①③ B.②③ C.③⑤ D.④⑤
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题五离子反应练习卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是( )
A.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+NH4++HCO=BaCO3↓+NH3·H2O+H2O
B.氢氧化铁溶于氢碘酸溶液:Fe(OH)3+3H+=Fe3++3H2O
C.向亚硫酸钠溶液中加入足量硝酸:SO32-+2H+=SO2↑+H2O
D.向AgNO3溶液中加入过量的氨水:Ag++NH3·H2O=AgOH↓+NH4+
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题九化学反应速率化学平衡练习卷(解析版) 题型:填空题
工业上合成氨的反应:N2(g)+3H2(g)  2NH3(g)ΔH=-92.60 kJ·mol-1。
2NH3(g)ΔH=-92.60 kJ·mol-1。
(1)在绝热、容积固定的密闭容器中发生反应:N2(g)+3H2(g)  2NH3(g),下列说法能说明上述反应向正反应方向进行的是________(填序号)。
2NH3(g),下列说法能说明上述反应向正反应方向进行的是________(填序号)。
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成6n mol N—H键的同时生成2n mol H—H键
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
④混合气体的平均摩尔质量增大
⑤容器内的气体密度不变
(2)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据:
时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
NH3 | 0 | 0.20 |
| 1.00 | 1.00 |
根据表中数据计算:
①反应进行到2 h时放出的热量为________ kJ。
②0~1 h内N2的平均反应速率为________ mol·L-1·h-1。
③此温度下该反应的化学平衡常数K=________(保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00 mol,化学平衡将向________方向移动(填“正反应”或“逆反应”)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题一物质的组成性质和分类练习卷(解析版) 题型:选择题
下列有关物质的性质与应用相对应的是( )
A.NH3极易溶于水,可用作制冷剂
B.Al2O3熔点高,可用作耐高温材料
C.SO2具有氧化性,可用于漂白品红、织物等
D.BaCO3能与盐酸反应,可用于治疗胃酸过多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com