
硫元素有多种化合价,可形成多种化合物。
(1)常温下用1 mol·L﹣1 100 mL NaOH溶液恰好完全吸收0.1 mol SO2气体,此反应的离子方程式为 ;该溶液pH_______7(填“=”“>”或“<”)。
(2)某同学在常温下设计如下实验流程探究Na2S2O3的化学性质。

实验①可说明________(填字母)
A.该Na2S2O3溶液中水电离的c(OH﹣)=10﹣8mol/L
B.H2S2O3是一种弱酸
C.Na2S2O3是一种弱电解质
D.Na2S2O3水解方程式为S2O32﹣+2H2O=H2S2O3+2OH﹣
写出实验②发生反应的离子方程式 。
(3)实验室制得的Na2S2O3粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O(摩尔质量为248g/mol)的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。称取1.28 g的粗样品溶于水,用0.40mol/L KMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32﹣全部被氧化时,消耗KMnO4溶液体积20.00 mL。(已知:5S2O32﹣+8MnO4﹣+14H+=8Mn2++10SO42﹣+7H2O)。
试回答:
①KMnO4溶液置于——(填“酸式”或“碱式”)滴定管中,滴定终点的现象为 。
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果_____________(填“偏高”“偏低”或“不变”)。
③产品中Na2S2O3·5H2O的质量分数为 。
(1)SO2+OH-=HSO3- (2分) < (2分)
(2)B (2分) S2O32- +5H2O +4Cl2 + 2Ba2+ =2BaSO4↓+8Cl- +10H+ (2分)
(3)①酸式(2分) 当最后一滴液体滴入时,溶液恰好由无色变为浅紫红色,且半分钟内不变色(2分)
②偏低(2分) ③96.9%
【解析】
试题分析: (1) 1 mol·L﹣1 100 mL NaOH为0.1mol,所以n(NaOH): n(SO2)=1:1,所以恰好生成酸式盐:离子方程式为:SO2+OH-=HSO3- 。生成的HSO3- 电离大于水解,所以溶液显酸性,pH<7。
(2)实验1测得Na2S2O3 溶液显碱性,pH=8,所以水解促进电离,水电离得c(H+)=c(OH﹣)=10﹣6mol/L,A错误;Na2S2O3 溶液水解呈碱性,能说明H2S2O3是一种弱酸,B正确;Na2S2O3是盐类,是强电解质,C错误;H2S2O3是二元弱酸,所以Na2S2O3水解分两步,D错误;故选B。
实验②中有白色沉淀生成,说明生成了BaSO4,所以发生了氧化还原反应,S2O32﹣ 被氧化为了SO42﹣ ,所以发生的反应方程式为:S2O32- +5H2O +4Cl2 + 2Ba2+ =2BaSO4↓+8Cl- +10H+ 。
(3)①用酸性高锰酸钾溶液滴定Na2S2O3 溶液,所以滴定终点的现象为“当最后一滴液体滴入时,溶液恰好由无色变为浅紫红色,且半分钟内不变色”;
②滴定过程中震荡不充分,则会使滴定终点过早到达,使用的标准液的体积会偏小,所以根据公式C测=C标V标/V测 可知,若V标偏小,则所测样品的质量分数会偏小。
③据反应方程式:5S2O32﹣+8MnO4﹣+14H+=8Mn2++10SO42﹣+7H2O,可知5n(S2O32﹣)=8n(MnO4﹣),所以n(Na2S2O3·5H2O)= n(S2O32﹣)=0.625 n(MnO4-)=0.625×0.40mol/L×20.00 mL×10-3 =0.005mol,所以Na2S2O3·5H2O的质量分数=0.005mol×248g/mol÷1.28 g×100%=96.9%.
考点:本题考查的是离子方程式的书写、盐类水解、氧化还原反应的配平、氧化还原滴定、误差分析、计算等知识。


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
| 化合价 | -2 | -1 | 0 | +2 | +4 | +6 | +7 |
| 代表物的化学式 | Na2S等 Na2S等 |
FeS2 | S | Na2S2O3 | SO2等 SO2等 |
SO3或H2SO4或Na2SO4 | Na2S2O8 |

查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省德州市高三1月月考化学试卷(解析版) 题型:填空题
(1)硫元素有多种化合价,可形成多种化合物。填写下表中的空白:
|
化合价 |
-2 |
-1 |
0 |
+2 |
+4 |
+6 |
+7 |
|
代表物的化学式 |
|
FeS2 |
S |
Na2S2O3 |
|
SO3或H2SO4或Na2SO4 |
Na2S2O8 |
(2)已知NaHSO3溶液显弱酸陛,请写出该溶液中存在的各种平衡反应的离子方程式: 。
(3)请按照浓度由大到小的顺序排列Na2SO3溶液中的离子: 。
Na2SO3溶液放置于空气中一段时间后,溶液的pH (填“增大”“减小”或“不变”)。(不考虑水的蒸发)原因是
。
(4)某同学设计如下实验流程探究Na2S2O3的化学性质。
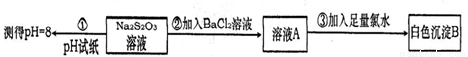
实验①可说明Na2S2O3能发生水解,实验②③说明Na2S2O3具有 性。请你预测Na2S2O3还可能具有的化学性质(列举2条即可) 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合价 | -2 | -1 | 0 | +2 | +4 | +6 | +7 |
| 代表物的化学式 | ______ | FeS2 | S | Na2S2O3 | ______ | SO3或H2SO4或Na2SO4 | Na2S2O8 |
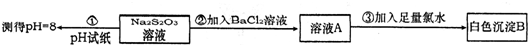
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省淄博潍坊市高三(上)期末化学试卷(解析版) 题型:填空题
| 化合价 | -2 | -1 | 0 | +2 | +4 | +6 | +7 |
| 代表物的化学式 | FeS2 | S | Na2S2O3 | SO3或H2SO4或Na2SO4 | Na2S2O8 |
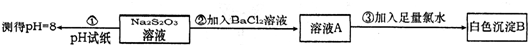
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com