
【题目】下列叙述正确的个数是( )
①配位键在形成时,是由成键双方各提供一个电子形成共用电子对 ②s-s σ键与s-p σ键的电子云形状相同 ③Ge是ⅣA族的一个主族元素,其核外电子排布式为Ge:[Ar]4s24p2,属于P区元素 ④非极性分子往往是高度对称的分子,比如BF3,PCl5,H2O2,CO2这样的分子 ⑤冰中存在极性共价键和氢键两种化学键的作用 ⑥Cu(OH)2是一种蓝色的沉淀,既溶于硝酸、浓硫酸,也能溶于氨水中 ⑦熔融状态的HgCl2不能导电,HgCl2的稀溶液有弱的导电能力且可作手术刀的消毒液,从不同角度分类HgCl2是一种共价化合物、非电解质、盐 ⑧中心原子采取sp3杂化的分子,其立体构型不一定是正四面体形 ⑨键长:C-H<N-H<O-H ⑩第一电离能:Si<C<N<O<F
A. 1 B. 2 C. 3 D. 4
【答案】B
【解析】①配位键在形成时,含有孤电子对的原子提供电子、含有空轨道的原子提供轨道,二者形成配位键,故①错误;②S能级电子云是球形,P能级电子云是哑铃型,所以s-s σ键与s-p σ键的电子云形状不同,故②错误; ③根据最后排入电子名称确定元素在周期表中所属区名称,Ge是ⅣA族的一个主族元素,其核外电子排布式为Ge:[Ar]3d104s24p2,属于P区元素,故③错误;④H2O2结构为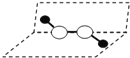 ,结构不对称,属于极性分子,故④错误;⑤冰中存在极性共价键和氢键两种作用,但氢键不是化学键,故⑤错误;⑥氢氧化铜能和硝酸、浓硫酸发生中和反应,溶于硝酸、浓硫酸,氢氧化铜能和氨水反应生成络合物离子银氨离子,所以氢氧化铜能溶于氨水中,故⑥正确;⑦HgCl2的稀溶液有弱的导电能力,可作手术刀的消毒液,是电离出的汞离子使蛋白质变性,说明其是弱电解质,故⑦错误;⑧中心原子采取sp3杂化的分子,VSEPR模型是正四面体,但其立体构形不一定是正四面体,如:水和氨气分子中中心原子采取sp3杂化,但H2O是V型,NH3是三角锥型,故⑧正确;⑨因C、N、O的原子半径依次减小,则键长:C-H>N-H>O-H,故⑨错误;⑩因N的2p轨道为半充满结构,相对稳定,则第一电离能:Si<C<O<N<F,故⑩错误;答案为B。
,结构不对称,属于极性分子,故④错误;⑤冰中存在极性共价键和氢键两种作用,但氢键不是化学键,故⑤错误;⑥氢氧化铜能和硝酸、浓硫酸发生中和反应,溶于硝酸、浓硫酸,氢氧化铜能和氨水反应生成络合物离子银氨离子,所以氢氧化铜能溶于氨水中,故⑥正确;⑦HgCl2的稀溶液有弱的导电能力,可作手术刀的消毒液,是电离出的汞离子使蛋白质变性,说明其是弱电解质,故⑦错误;⑧中心原子采取sp3杂化的分子,VSEPR模型是正四面体,但其立体构形不一定是正四面体,如:水和氨气分子中中心原子采取sp3杂化,但H2O是V型,NH3是三角锥型,故⑧正确;⑨因C、N、O的原子半径依次减小,则键长:C-H>N-H>O-H,故⑨错误;⑩因N的2p轨道为半充满结构,相对稳定,则第一电离能:Si<C<O<N<F,故⑩错误;答案为B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某溶液中含有大量的Cl﹣、Br﹣、I﹣,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl﹣、Br﹣、I﹣的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,原溶液中Cl﹣、Br﹣、I﹣的物质的量浓度之比为( )
Cl2的体积(标准状况) | 5.6L | 11.2L | 22.4L |
n(Cl﹣)/mol | 1.5 | 2.0 | 3.0 |
n(Br﹣)/mol | 3.0 | 2.8 | 1.8 |
n(I﹣)/mol | x(x>0) | 0 | 0 |
A. 5:15:4 B. 5:12:4
C. 15:30:8 D. 条件不足,无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为短周期的主族元素,其原子序数依次增大。X元素形成的单质是自然界中含量最多的气体,Y是电负性最大的元素,W的原子最外层电子数与核外电子总数之比为3︰8,X的原子序数是Z的原子序数的一半,U是第四周期11列元素。
(1)U基态原子的价电子排布式__________________,Z在周期表中位置为___________________。
(2)在OY2中,氧原子的杂化轨道类型是____________。
(3)Z、W的最高价氧化物的水化物,酸性较强的是______。(填最高价氧化物的水化物的化学式)
(4)U的含氧化合物M晶胞如图所示(“○”表示氧原子),则M的化学式为________。
(5)已知:[Cu(NH3)4]2+具有对称的空间构型,且当[Cu(NH3)4]2+中的两个NH3被两个Cl﹣取代时,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为_____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的鉴别方法不正确的是( )
A.用焰色反应鉴别NaCl、KCl和K2SO4
B.用氢氧化钠溶液鉴别MgCl2溶液、AlCl3溶液
C.利用丁达尔效应鉴别Fe(OH)3胶体与FeCl3溶液
D.用氯化钙溶液鉴别Na2CO3和NaHCO3两种溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式:
(2)H3PO2及NaH2PO2)均可将溶液中的银离子还原为银单质,从而可用于化学镀银。
①(H3PO2)中,磷元素的化合价为
②利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4︰1,则氧化产物为: (填化学式)
③NaH2PO2是正盐还是酸式盐? 其溶液显 性(填弱酸性、中性、或者弱碱性)
(3)(H3PO2)的工业制法是:将白磷(P4)与氢氧化钡溶液反应生成PH3气体和Ba(H2PO2),后者再与硫酸反应,写出白磷与氢氧化钡溶液反应的化学方程式:
(4)(H3PO2)也可以通过电解的方法制备。工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):

①写出阳极的电极反应式
②分析产品室可得到H3PO2的原因
③早期采用“三室电渗析法”制备H3PO2,将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是 杂质。该杂质产生的原因是:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断正确的是( )
A.元素周期表中查得的相对原子质量为同位素的相对原子质量
B.化学键的变化一定会引起化学反应的变化
C.酸性氧化物一定是非金属氧化物
D.钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选考〔化学—物质结构与性质](13分)
钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,
反应原理为: 2Mn2++5S2O82-+8H2O![]() 2MnO4-+10SO42-+16H+
2MnO4-+10SO42-+16H+
(1)基态锰原子的核外电子排布式为 _
(2)上述反应涉及的元素属于同主族元素,其第一电离能由大到小的顺序为 (填元素符号)。
(3)已知H2.S2O8的结构如图。

①H2.S2O8硫原子的轨道杂化方式为 。
②上述反应中被还原的元素为 。
③上述反应每生成1 mol MnO4 -,S2O82- 断裂的共价键类型及其数目为 。
(4)一定条件下,水分子间可通过O一H...O氢键将从H2O分子结合成三维骨架结构,其中的多面体孔穴中可包容气体小分子,形成笼形水合包合物晶体
①下图是一种由水分子构成的正十二面体骨架(“o”表示水分子),其包含的氢键数为 ;

②实验测得冰中氢键的作用能为18.8目kJ·mol-1,而冰的熔化热为5.0kJ·mol-1,其原因可能是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是( )

A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:Cu2+ + 2e-= Cu
C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D.a和b用导线连接时,铁片上发生的反应为:Fe — 3e-= Fe3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com