
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
分析 若12mL全部为NO2,由3NO2+H2O=2HNO3+NO可知剩余气体为4mL,大于实际剩余气体2mL,故剩余气体为NO或氧气.
若剩余气体为氧气,根据4NO2+O2+2H2O=4HNO3计算参加反应二氧化氮、氧气体积,进而计算原混合气体中氧气体积;
若剩余气体为NO,根据3NO2+H2O=2HNO3+NO计算该反应中二氧化氮体积,进而计算4NO2+O2+2H2O=4HNO3反应中消耗二氧化氮、氧气总体积,结合二氧化氮与氧气按4:1反应计算氧气体积.
解答 解:若12mL全部为NO2,由3NO2+H2O=2HNO3+NO可知剩余气体为4mL,大于实际剩余气体2mL,故剩余气体为NO或氧气.
若剩余气体为氧气,则4NO2+O2+2H2O=4HNO3中参加反应二氧化氮、氧气体积总体积为12mL-2mL=10mL,则反应的氧气为10mL×$\frac{1}{5}$=2mL,故原混合气体中氧气体积为2mL+2mL=4mL;
若剩余气体为NO,根据3NO2+H2O=2HNO3+NO可知,该反应中二氧化氮体积为2mL×3=6mL,则4NO2+O2+2H2O=4HNO3反应中消耗二氧化氮、氧气总体积为12mL-6mL=6mL,则氧气体积为6mL×$\frac{1}{5}$=1.2mL,
故选:D.
点评 本题考查混合物计算,关键是分析剩余气体的成分,再根据反应的方程式计算,侧重考查学生分析计算能力,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 2H++2e-═H2↑ | B. | 2H2O+O2+4e-═4OH- | ||
| C. | Fe-3e═Fe3+ | D. | Fe-2e═Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
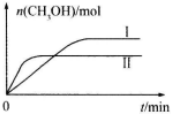
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在使石蕊试液变红的溶液中:Na+、NH4+、NO3-、AlO2- | |
| B. | 在含有较多Al3+的溶液中:Na+、K+、SO42-、HCO3- | |
| C. | 室温下,在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液中:K+、I-、Cl-、HS- | |
| D. | 在无色溶液中:SO42-、Cl-、NH4+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
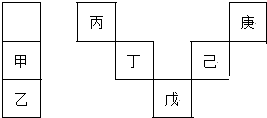
| A. | 丙与戊的原子序数相差28 | |
| B. | 气态氢化物的稳定性:庚<己<戊 | |
| C. | 常温下,庚和乙形成的化合物易溶于水 | |
| D. | 丁的最高价氧化物不与任何酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | ⅠA | ⅡA | ⅢA | ⅠVA | VA | VⅠA | VⅡA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ |
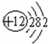 ,⑧
,⑧ ;
; .最不活泼的元素是Ar.(以上均填元素名称)
.最不活泼的元素是Ar.(以上均填元素名称)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,关于该有机物下列叙述正确的是( )
,关于该有机物下列叙述正确的是( )| A. | 不能使酸性KMnO4溶液褪色 | |
| B. | 不能使溴水褪色 | |
| C. | 在加热和催化剂作用下,最多能和3mol H2反应 | |
| D. | 一定条件下,不能和NaOH醇溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com