

| ||
| 5000g×64% |
| 64g/mol |
| 1 |
| 2 |
| 25.0mol |
| 1.0mol/L |


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
| A、胶体一定是混合物 |
| B、胶体与溶液的本质区别是有丁达尔效应 |
| C、将饱和氯化铁溶液滴入稀氢氧化钠溶液中加热,可得氢氧化铁胶体 |
| D、胶体属于介稳体系 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.4g金属镁变成镁离子时失去的电子数目为0.1NA |
| B、2g氢气所含分子数目为2NA |
| C、在标准状况下,以任意比混合的氦气和氧气混合物22.4L,所含分子数为NA |
| D、在25℃、101kPa时,11.2L氮气所含的原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
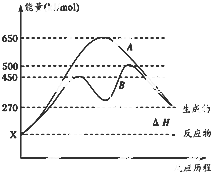 (1)已知:①Fe(s)+
(1)已知:①Fe(s)+| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2和H2在点燃或光照条件下可合成氨 |
| B、氨是共价化合物,硝酸是离子化合物 |
| C、氨气遇到浓硝酸会发生反应产生白烟 |
| D、由氨制取硝酸过程中,氮元素被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
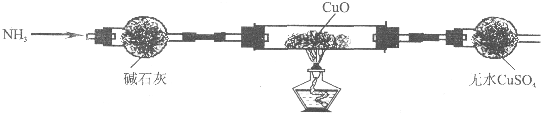
查看答案和解析>>
科目:高中化学 来源: 题型:
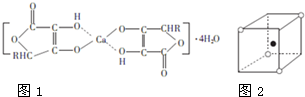 钙的化合物在共农业生产和生活中有广泛的应用.
钙的化合物在共农业生产和生活中有广泛的应用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com