
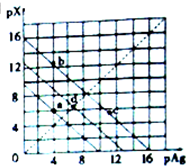
 某温度时,卤化银(AgX,X=Cl,Br,I)的3条沉淀溶解平衡曲线如图所示,AgCl,AgBr,AgI的Ksp依次减小.已知pAg=-lgc(Ag+),pX=-lgc(X-),下列说法错误的是( )
某温度时,卤化银(AgX,X=Cl,Br,I)的3条沉淀溶解平衡曲线如图所示,AgCl,AgBr,AgI的Ksp依次减小.已知pAg=-lgc(Ag+),pX=-lgc(X-),下列说法错误的是( )| A. | 由a点可知该温度下Ksp(AgCl)=l0-10 | |
| B. | 加入AgNO3可使溶液由b点变到c点 | |
| C. | d点是在水中加入足量的AgBr形成的饱和溶液 | |
| D. | 坐标点(14,8)形成的溶液是AgI的不饱和溶液 |
分析 由图可知,纵横坐标的乘积越大,Ksp(AgX)越小,则a点在AgCl的沉淀溶解平衡曲线上,d点在AgBr在沉淀溶解平衡曲线上,b、c点在AgI的沉淀溶解平衡曲线上,
A.Ksp(AgCl)=c(Ag+)c(Cl-);
B.加入AgNO3可使溶液,c(Ag+)增大,AgI的溶解平衡逆向移动;
C.曲线上的点为溶解平衡点;
D.坐标点(14,8)与坐标点(14,2)相比,Qc(AgI)<Ksp(AgI).
解答 解:A.Ksp(AgCl)=c(Ag+)c(Cl-)=l0-6×l0-4=l0-10,故A正确;
B.加入AgNO3可使溶液,c(Ag+)增大,AgI的溶解平衡逆向移动,则c(I-)变小,不能使使溶液由b点变到c点,故B错误;
C.曲线上的点为溶解平衡点,则d点是在水中加入足量的AgBr形成的饱和溶液,故C正确;
D.坐标点(14,8)与坐标点(14,2)相比,Qc(AgI)<Ksp(AgI),则坐标点(14,8)形成的溶液是AgI的不饱和溶液,故D正确;
故选B.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握图中离子浓度变化、溶解平衡点的判断为解答的关键,侧重分析与应用能力的考查,注意坐标上数字的乘积越大、离子浓度乘积越小,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 以上反应是可逆反应 | |
| B. | 放电时,镉为正极 | |
| C. | 充电时电池上标有“+”号的电极连接电源正极 | |
| D. | 以镍镉电池为电源,电解Na2CO3溶液,当收集到气体的总体积为33.6L电池中转移了2mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4项 | B. | 3项 | C. | 2项 | D. | 1项 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
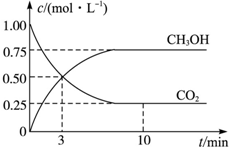 工业上设计用CO2来生产燃料甲醇,既减少二氧化碳气体,又得到宝贵的能源物质.为了探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3mol H2,某温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得CO2和CH3OH(g)的浓度随时间的变化关系如图所示.
工业上设计用CO2来生产燃料甲醇,既减少二氧化碳气体,又得到宝贵的能源物质.为了探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3mol H2,某温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得CO2和CH3OH(g)的浓度随时间的变化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
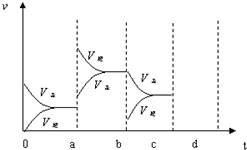 如图表示在密闭容器中反应:2SO2+O2?2SO3△H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是升温;b~c过程中改变的条件可能是减小生成物 SO3 的浓度; 若增大压强时,反应速度变化情况画在c~d处.以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将(容器不与外界进行热交换,填“升高”或“降低”);达新平衡时,容器内混合气体的平均相对分子质量比原平衡时(填“增大”、“减小”或“相等”).以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将(容器不与外界进行热交换,填“升高”或“降低”);达新平衡时,容器内混合气体的平均相对分子质量比原平衡时(填“增大”、“减小”或“相等”).
如图表示在密闭容器中反应:2SO2+O2?2SO3△H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是升温;b~c过程中改变的条件可能是减小生成物 SO3 的浓度; 若增大压强时,反应速度变化情况画在c~d处.以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将(容器不与外界进行热交换,填“升高”或“降低”);达新平衡时,容器内混合气体的平均相对分子质量比原平衡时(填“增大”、“减小”或“相等”).以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将(容器不与外界进行热交换,填“升高”或“降低”);达新平衡时,容器内混合气体的平均相对分子质量比原平衡时(填“增大”、“减小”或“相等”).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 可逆反应的化学计量数数:a>b+c | |
| B. | 压缩容器的容积时,v正增大,v逆减小 | |
| C. | 达到新平衡时,Y,Z浓度增大,K值变大 | |
| D. | 达到新平衡时,加入物质X反应正动,X的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向碳酸钠溶液中加醋酸 CO32-+2H+═H2O+CO2↑ | |
| B. | 向稀硫酸溶液中投入铁粉 2Fe+6H+═2Fe3++3H2↑ | |
| C. | 向盐酸中投入碳酸钙 CO32-+2H+═H2O+CO2↑ | |
| D. | 硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com