
| A. | H2O的摩尔质量为18g | |
| B. | 1mol O2的质量为32g•mol-1 | |
| C. | 相同质量的O2和O3,所含分子数不同,所含原子数相同 | |
| D. | 相同物质的量的CO2 和CO,所含O原子的个数比为1:1 |
分析 A、摩尔质量单位为g/mol;
B、质量单位为g;
C、n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$计算物质的量,元素质量守恒,氧原子质量守恒;
D、分子物质的量×原子数=原子物质的量.
解答 解:A、摩尔质量单位为g/mol,H2O的摩尔质量为18g/mol,故A错误;
B、质量单位为g,1mol O2的质量为32g,故B错误;
C、n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$计算物质的量,相同质量的O2和O3,物质的量不同,分子数不同,元素质量守恒,氧原子质量守恒,氧原子数相同,故C正确;
D、分子物质的量×原子数=原子物质的量吗,相同物质的量的CO2 和CO,所含O原子的个数比为2:1,故D错误;
故选C.
点评 本题考查了摩尔质量概念分析,物质的量和微粒数的计算应用,掌握基础是解题关键,题目较简单.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
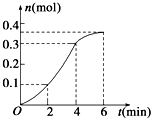
| A. | 反应开始2 min内平均反应速率最大 | |
| B. | 反应速率先增大后减小 | |
| C. | 反应2 min到第4 min内温度对反应速率的影响比浓度大 | |
| D. | 反应在第2 min到第4 min内生成CO2的平均反应速率为前2 min的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于8.0 g | B. | 等于8.00 g | C. | 大于8.0 g | D. | 等于0.2 g |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | n | B. | $\frac{n}{m}$ | C. | $\frac{12n}{m}$ | D. | n×NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知在常温下醋酸铵溶液呈中性,则溶液中c(H+)=c(OH-)=10-7mol•L-1 | |
| B. | 把物质的量浓度相等的盐酸和醋酸溶液分别稀释m倍和n倍,欲使稀释后两溶液的pH相同,则m>n | |
| C. | 常温下,某溶液中由水电离出来的c(OH-)=1.0×10-12 mol•L-1,则该溶液的pH可能是2或12 | |
| D. | 用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液,酸碱恰好完全反应时所得溶液的pH=7,因为5<7<8,在石蕊的变色范围内,所以选择石蕊作为指示剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com