
| A、CuFeS2仅作还原剂,硫元素被氧化 |
| B、每生成1mol Cu2S,有4 mol硫被氧化 |
| C、SO2只是氧化产物,FeS只是还原产物 |
| D、每转移1.2 mol电子,有0.2 mol硫被氧化 |


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
| A、石灰乳与Na2CO3溶液混合:Ca2++CO32-═CaCO3↓ | ||||
B、用惰性电极电解氯化镁溶液:2Cl-+2H2O
| ||||
| C、将碳与足量的浓硫酸共热反应后的气体混合物,通入过量氢氧化钠溶液中:CO2+SO2+4OH-═SO32-+CO32-+2H2O | ||||
| D、漂粉精溶液滴入硫酸:Cl-+ClO-+2H+═Cl2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解水时,加少量硫酸可使电解速率加快 |
| B、H2O2中加入少量MnO2,即可迅速放出气体 |
| C、在木炭粉中加入微量氯酸钾,燃烧时极为剧烈 |
| D、用锌与稀硫酸反应制备氢气时,加入少量硫酸铜加快反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素的种类由核内质子数决定 |
| B、原子的种类由核内质子数和中子数共同决定 |
| C、分子的种类由分子的组成决定 |
| D、原子的质量主要由原子核中质子和中子决定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠钾合金可用于快中子反应堆作热交换剂 |
| B、镁燃烧发出耀眼的白光,常用于制造信号弹和焰火 |
| C、铜化学性质不活泼,故古代用作铸币材料 |
| D、铝和Fe2O3混合物在常温下会发生剧烈反应,可以用于野外焊接钢轨 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等体积、等物质的量浓度的NaCl(aq)离子总数大于NaClO(aq)中离子总数 |
| B、pH=3的硫酸溶液中水的电离程度等于pH=11的氨水溶液中水的电离程度 |
| C、0.1 mol/L的NaHA溶液pH=5,则溶液:c(HA-)>c(H+)>c(A2-)>c(H2A) |
| D、向NH4HSO4溶液中滴加NaOH溶液至中性,所得混合液:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、34g H2O2中含有的阴离子数为NA |
| B、标准状况下,22.4L O2作氧化剂时转移电子数一定为4NA |
| C、T℃时,1L pH=6纯水中,含10-6NA个OH- |
| D、10L 0.1mol?L-1的Na2CO3溶液中,Na+、CO32-总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
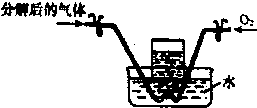 已知Fe(NO3)2受热分解产物为金属氧化物、NO2、O2.某兴趣小组同学对固体产物中Fe的化合物进行了如下探究:
已知Fe(NO3)2受热分解产物为金属氧化物、NO2、O2.某兴趣小组同学对固体产物中Fe的化合物进行了如下探究:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com