
某温度时,把1 mol N2O4气体通入体积为10 L的真空密闭容器中,立即出现红棕色,反应进行4 s时NO2的浓度为0.04 mol·L-1,再经过一定时间后,反应达到平衡,这时容器内压强为开始时的1.8倍。则下列说法正确的是( )
A.前4 s以N2O4的浓度变化表示的平均反应速率为0.01 mol·L-1·s-1
B.4 s时容器内的压强为开始时的1.2倍
C.平衡时容器内含0.4 mol N2O4
D.平衡时容器内含0.8 mol NO2
B [ N2O4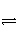
 2NO2
2NO2
n起始/mol 1 0
n变化/mol 0.2 0.04×10
n4 s/mol 0.8 0.4
前4 s N2O4的浓度变化为0.2 mol/10 L=0.02 mol·L-1;
因此前4 s N2O4的平均反应速率为0.005 mol·L-1·s-1,A不正确。
4 s时气体的总的物质的量为0.8 mol+0.4 mol=1.2 mol。
根据压强比等于物质的量比可得B正确。
设达到平衡时N2O4的物质的量变化了x。
N2O4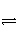
 2NO2
2NO2
n起始/mol 1 0
n变化/mol x 2x
n平衡/mol 1-x 2x
根据已知条件1 mol-x+2x=1 mol+x=1.8 mol,解得x=0.8 mol。
平衡时N2O4的物质的量为1 mol-x=1 mol-0.8 mol=0.2 mol,NO2的物质的量为2x=2×0.8 mol=1.6 mol,故C、D不正确。]


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
在水中加等物质的量的Ag+、Pb2+、Na+、SO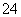 、NO
、NO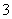 、Cl-,该溶液放在用惰性电极作电极的电解槽中,通电片刻,则氧化产物与还原产物质量比为( )
、Cl-,该溶液放在用惰性电极作电极的电解槽中,通电片刻,则氧化产物与还原产物质量比为( )
A.35.5∶108 B.16∶207 C.8∶1 D.108∶35.5
查看答案和解析>>
科目:高中化学 来源: 题型:
人们对酸碱的认识,已有几百年的历史,经历了一个由浅入深、由低级到高级的认识过程。
(1)1905年富兰克林提出了酸碱溶剂理论。溶剂理论认为:凡能离解而产生溶剂正离子的物质为酸,凡能离解而产生溶剂负离子的物质为碱。试写出液氨自身弱电离的方程式: 。
(2)1923年丹麦化学家布朗斯特和英国化学家劳莱提出了酸碱质子理论。凡是能够释放质子(氢离子)的任何含氢原子的分子或离子都是酸;凡是能与质子(氢离子)结合的分子或离子都是碱。按酸碱质子理论,下列粒子在水溶液中既可看作酸又可看作碱的是 。
A.H2O B.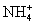 C.OH- D.
C.OH- D.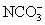 E.CH3COO- F.Cl-
E.CH3COO- F.Cl-
(3)1923年路易斯提出了广义的酸碱概念。凡是能给出电子对而用来形成化学键的物质是碱;凡是能和电子对结合的物质都是酸。如:
酸(电子对接受体)+碱(电子对给予体) 反应产物
反应产物
试指出下列两个反应中的酸或碱
①H3BO3+H2O====H++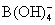
该反应中的碱是 (填:H3BO3或H2O)
②NaH+H2O====NaOH+H2↑
该反应中的酸是 (填:NaH或H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
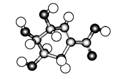 据报道莽草酸是可有效对付致命的H7N9型禽流感病毒的药物“达菲”的重要成分。莽草酸的结构如右图所示,下列说法不正确的是 ( )
据报道莽草酸是可有效对付致命的H7N9型禽流感病毒的药物“达菲”的重要成分。莽草酸的结构如右图所示,下列说法不正确的是 ( )
A.莽草酸是一种多羟基酸,易溶于水
B.莽草酸的分子式为C7H10O5,其属于烃
C.该物质能发生的反应有加成反应、酯化反应、氧化反应等
D.1 mol莽草酸能与4 mol金属钠反应
查看答案和解析>>
科目:高中化学 来源: 题型:
如果苯泄漏,以下处理方法错误的是 ( )
A.撤离污染区人员至安全地带,防止苯蒸气对人体造成危害
B.切断电源,因为苯是一种易挥发、易燃物质,否则可能引起爆炸
C.采用活性炭吸附地面液体
D.由于现场比较空旷,采用点火焚烧的办法清除泄漏物
查看答案和解析>>
科目:高中化学 来源: 题型:
2007年诺贝尔化学奖得主GerhardErtl对金属Pt表面催化CO氧化反应的模型进行了深入研究。下列关于 的说法正确的是( )
的说法正确的是( )
A. 和
和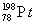 的质子数相同,互称为同位素
的质子数相同,互称为同位素
B. 和
和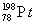 的中子数相同,互称为同位素
的中子数相同,互称为同位素
C. 和
和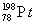 的核外电子数相同,是同一种核素
的核外电子数相同,是同一种核素
D. 和
和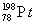 的质量数不同,不能互称为同位素
的质量数不同,不能互称为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )

①两烧杯中铜片表面均无气泡产生
②甲中铜片是正极,乙中铜片是负极
③两烧杯中溶液的c(H+)均减小
④产生气泡的速率甲比乙慢
⑤甲中SO42—向Zn片移动,H+向Cu片移动
⑥乙中电流从Cu片流向Zn片
⑦甲乙两烧杯中Cu片的质量均不变
A.①②③ B.③⑤⑦ C.④⑤⑥ D.②③④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如下:
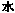



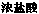 根据要求填空:
根据要求填空: 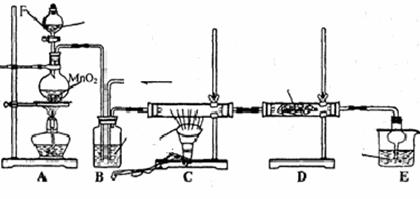
(1)装置A中反应的化学方程式为 。
(2)B装置有三种功能:①控制气流速度;②___ ___;③__ ___________。
(3)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x的取值范围是_____。
(4)E装置的作用是____________(填编号)。
A.收集气体 B.吸收氯气 C.防止倒吸 D.吸收氯化氢
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式_____________________________ 。
(6)装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法为______。该装置还有缺陷,原因是没有进行尾气处理,其尾气的主要成分是_______(填编号)。
A.CH4 B.CH3Cl C.CH2Cl2 D.CHCl3 E.CCl4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com