
【题目】下列生产、生活等实际应用,不能用勒夏特列原理解释的是
A. 氯水中有下列平衡Cl2+H2O ![]() HCl+ HClO,当加入AgNO3溶液后溶液颜色变浅
HCl+ HClO,当加入AgNO3溶液后溶液颜色变浅
B. 合成氨工业中使用铁触媒做催化剂
C. 合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施
D. 对2HI(g)![]() H2(g)+I2(g),保持容器体积不变,通入氢气可使体系颜色变浅
H2(g)+I2(g),保持容器体积不变,通入氢气可使体系颜色变浅
【答案】B
【解析】
勒沙特列原理是:如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动。
A、氯水中有下列平衡:Cl2+H2OHCl+HClO,当加入AgNO3溶液后,银离子和氯离子结合生成氯化银沉淀,平衡正向移动,氯气浓度减小,溶液颜色变浅,能用勒夏特列原理解释,故A不选;B、由于催化剂不影响化学平衡,不能用勒夏特列原理解释,故B选;C、由于合成氨反应是放热反应,降低温度,平衡向着放热方向移动,即正向移动,能够用勒夏特列原理解释,故C不选;D、通入氢气后,氢气浓度增大,平衡向着氢气浓度减小的方向移动,即逆向移动,碘蒸气浓度减小,气体颜色变浅,能够用勒夏特列原理解释,故D不选;故选B。


 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O(摩尔质量376g/mol)是一种氧气吸收剂,红棕色晶体,易被氧化;易溶于盐酸,微溶于乙醇,难溶于水和乙醚。其制备装置(已省略加热及支持装置)和步骤如下:
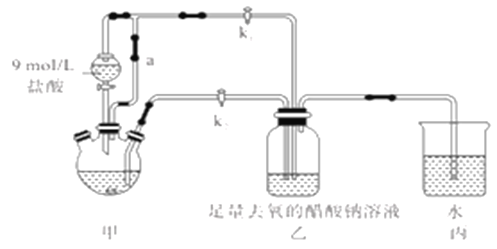
①检查装置气密性,往三颈烧瓶中依次加入过量锌粉,200mL0.200mol/LCrC13溶液。
②关闭k2打开k1,旋开分液漏斗的旋塞并控制好滴速。
③待三颈烧瓶內的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,把溶液转移到装置乙中。当出现大量红棕色晶体时,关闭分液漏斗的旋塞。
④将装置乙中混合物快速过滤、洗涤和干燥,称量得到11.28g[Cr(CH3COO)2]2·2H2O
(1)装置甲中连通管a的作用是________,如何检验甲装置的气密性是否良好?__________。
(2)生成红棕色晶体的离子反应方程式____________________________。
(3)步骤③中溶液自动转移至装置乙中的实验操作为________________。
(4)装置丙的作用是________________。
(5)为得到纯净干燥的产品,洗涤时按使用的先后顺序选用下列洗涤剂__________(填序号)。
①乙醚 ②蒸馏水(煮沸冷却) ③无水乙醇 ④盐酸
(6)本实验中[Cr(CH3COO)2]2·2H2O的产率是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。 请回答:

(1)B极是电源的__________极,C极的电极反应式为____________________________________,一段时间后丁中X极附近的颜色逐渐______________。(填“变深”或者“变浅”)
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为 ______________。
(3)现用丙装置给铜件镀银,则H应该是______________ (填“铜”或“银”),电镀液是___________ 溶液。当乙中溶液的pH是13时(此时乙溶液体积为500mL),丙中镀件上析出银的质量为________ g,甲中溶液的pH _____________(填“变大”、“变小”或“不变”)。
(4)若甲烧杯是在铁件表面镀铜,已知电镀前两电极质量相同,电镀完成后将它们取出,洗净、烘干、称量,发现二者质量相差5.12g,则电镀时电路中通过的电子为_______mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】俗名为“臭碱”的硫化钠广泛应用于冶金染料、皮革、电镀等工业。硫化钠的一种制备方法是Na2SO4+2C![]() Na2S+2CO2↑。设NA为阿伏加德罗常数的数值,下列说法正确的是( )
Na2S+2CO2↑。设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 0.1 mol·L-1的Na2SO4溶液中含SO42-的数目为0.1NA
B. 1 mol 13C原子所含中子数为6NA
C. 78 g Na2S中所含离子总数为2NA
D. 标准状况下,2.24 L CO2所含氧原子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸氯(C1NO)是有机合成中的重要试剂。可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+C12(g)![]() 2C1NO(g),
2C1NO(g),
(1)已知几种化学键的键能数据如下表(亚硝酸氯的结构为Cl-N=O):
化学键 | N≡O | Cl-Cl | Cl-N | N=O |
键能(kJ/mol) | 630 | 243 | a | 607 |
则2NO(g)+C12(g)![]() 2C1NO(g)反应的△H和a的关系为△H=____kJ/mol。
2C1NO(g)反应的△H和a的关系为△H=____kJ/mol。
(2)在1L的恒容密闭容器中充入2molNO(g)和1molC12(g),在不同温度下测得c(C1NO)与时间的关系如图A:
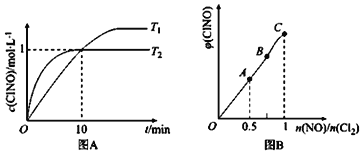
① 由图A可判断T1 ____T2,该反应的△H____0 (填“>”“<”或“=”)。
② 反应开始到10min时NO的平均反应速率v(NO)=______mol/(L·min)。
(3)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(C12)的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是________点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关光合作用的说法不正确的是( )
A.将无机物转化为有机物B.反应物的总能量高于生成物的总能量
C.将太阳能转变为化学能D.是自然界碳元素循环的重要途径
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作均要用玻璃棒,其中玻璃棒的作用相同的是:
①过滤 ②蒸发 ③溶解 ④向容量瓶转移溶液
A. ①和② B. ①和③ C. ③和④ D. ①和④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M元素的1个原子失去2个电子转移到Y元素的2个原子中去,形成化合物Z。下列说法中正确的是( )
A. Z是共价化合物
B. Z可表示为M2Y
C. Z的电子式可表示为 ![]()
D. M形成+2价阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氧化性![]() .现有一包铁粉和铜粉混合粉末,某实验小组为了确定其组成,利用
.现有一包铁粉和铜粉混合粉末,某实验小组为了确定其组成,利用![]() 的
的![]() 溶液(其他用品略),与混合粉末反应,实验结果如下(假定反应前后溶液体积不变):
溶液(其他用品略),与混合粉末反应,实验结果如下(假定反应前后溶液体积不变):
组别 | ① | ② | ③ | ④ |
| 50 | 50 | 50 | 50 |
混合粉末质量/ | 1.2 | 2.4 | 3.6 | 4.8 |
反应后剩余固体质量/ | 0 | 0.64 | 1.92 | 3.12 |
分析表中数据,下列结论不正确的是
A. 第①组反应后溶液中剩余![]()
B. 第②、③组剩余固体全是铜
C. 第④组的滤液中![]()
D. 原混合粉末中![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com