
| m |
| V |
| nM |
| nVm |
| M |
| Vm |
| V |
| Vm |
| m |
| M |
| V |
| Vm |
| m |
| M |
| V |
| Vm |
| m |
| M |
| m |
| V |
| nM |
| nVm |
| M |
| Vm |
| 44g/mol |
| 22.4L/mol |
| 5.6L |
| 22.4L/mol |
| 1 |
| 2 |
| 12.4g |
| 0.2mol |
| V |
| 22.4 |
| V |
| 22.4 |
| V |
| n |
| 7.5L | ||
|
| 15L |
| 76.1mol/L |
| 8.4 |
| 0.2 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
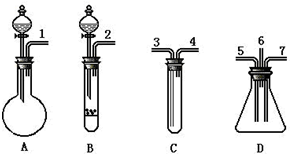 根据下面提供的仪器和试剂,完成验证SO2既有氧化性又有还原性的实验.可选用的仪器如图所示:
根据下面提供的仪器和试剂,完成验证SO2既有氧化性又有还原性的实验.可选用的仪器如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:
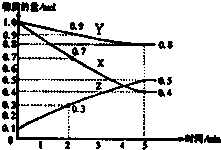 化学反应速率与生产、生活密切相关.
化学反应速率与生产、生活密切相关.| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标准状况) | 50 | 120 | 232 | 288 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 则乙醇发生酯化反应时,断裂的键是
则乙醇发生酯化反应时,断裂的键是 ②CH2=CH2③CH≡CH ④
②CH2=CH2③CH≡CH ④ -CH2OH⑤
-CH2OH⑤ -CH3⑥CH3COO-
-CH3⑥CH3COO- ⑦CH3CH2CH2CH2Br中属于芳香烃的是
⑦CH3CH2CH2CH2Br中属于芳香烃的是查看答案和解析>>
科目:高中化学 来源: 题型:
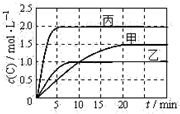 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以 | 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5mol A 0.5mol B | 1.5mol A 0.5mol B | 6.0mol A 2.0mol B |
| A、10min内甲容器中反应的平均速率:v(A)=0.05mol?(L?min)-1 |
| B、由图可知T1>T2,且该反应为吸热反应 |
| C、x=1,若平衡时保持温度不变,改变容器体积平衡不移动 |
| D、T2℃,丙容器比乙容器反应快的原因可能是使用了催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合金的熔点一般比各成分金属的低 |
| B、合金的硬度一般比各成分金属的大 |
| C、合金的性质一般是各成分金属性质的总和 |
| D、合金在工业上的用途比纯金属更广泛 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com