


科目:高中化学 来源: 题型:
| 压强/pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol?L-1 | 0.08 | 0.20 | 0.44 |
| A、当压强从2×105Pa,增加到5×105Pa时,平衡向左移动 |
| B、化学计量数:m+n=p |
| C、当压强从5×105Pa,增加到1×106Pa时,平衡不移动 |
| D、压强增至1×106Pa时,平衡常数变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,在Mg(OH)2的悬浊液中加入少量的 NH4Cl固体,c(Mg2+)增大 |
| B、25℃时饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| C、25℃时,Mg(OH)2固体在20mL0.1mol/L氨水中的Ksp比在20mL0.1mol/L NH4Cl溶液中的Ksp小 |
| D、25℃时,在Mg(OH)2的悬浊液加入NaF溶液后,Mg(OH)2不可能转化成为MgF2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 实验内容 | 试剂 | 现象和结论 |
| ① | 鉴别K2CO3和Na2SO3 | 盐酸、澄清的石灰水 | 产生无色无味气体,能使澄清的石灰水变浑浊的是K2CO3 |
| ② | 鉴别NO2和Br2蒸气 | 湿润的淀粉KI试纸 | 试纸变蓝色的是Br2蒸气 |
| ③ | 除去氯化钙溶液中的氯化铁杂质 | 生石灰 | 调节溶液的pH为3.7,再过滤 |
| ④ | 鉴别AlCl3溶液和MgCl2溶液 | 氨水 | 产生白色沉淀然后消失的是AlCl3溶液 |
| A、①③ | B、①②③ |
| C、②④ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 |  |  |  |
| A干燥Cl2 | B分离汽油与食盐溶液 | C实验室制取少量蒸馏水 | D比较Na2CO3与NaHCO3的稳定性 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X>Z>Y>W |
| B、Z>W>X>Y |
| C、Z>X>Y>W |
| D、Z>Y>X>W |
查看答案和解析>>
科目:高中化学 来源: 题型:
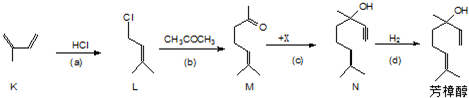

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com